
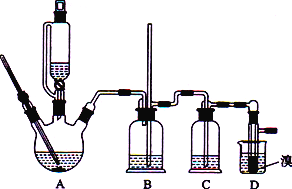
【题目】实验室用CH3CH2OH分两步制备1,2-二溴乙烷现用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
有关数据列表如下:
物质名称 | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/(g·cm-3) | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)装置A中发生的化学方程式为_________________________________,反应类型为________,在此制备实验中,要尽可能迅速地把反应温度提高到170 ℃左右,其最主要目的是________(填字母)。
a 引发反应 b减少副产物乙醚生成 c 防止乙醇挥发 d加快反应速率
(2)在装置C中应加入________(填字母),其目的是吸收反应中可能生成的酸性气体。
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3) 装置D中实验现象为_______________。
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在________(填“上”或“下”)层。
(5)反应过程中应用冷水冷却装置D,其主要目的是____________________________。
【答案】C2H5OH ![]() CH2=CH2↑+ H2O 消去反应 b c 溴的颜色完全褪去 下 避免溴大量挥发
CH2=CH2↑+ H2O 消去反应 b c 溴的颜色完全褪去 下 避免溴大量挥发
【解析】
装置A为乙烯的制备装置,装置B是根据气压原理设计的防堵塞装置,如果D中导气管发生堵塞,A中产生的乙烯气体会导致装置B中压强增大,长导管液面会上升,浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,装置C中盛有的氢氧化钠溶液吸收酸性气体,防止干扰1,2-二溴乙烷的制备,装置D是溴水与乙烯反应生成1,2-二溴乙烷的反应器。
(1)装置A中乙醇在浓硫酸作用下,170℃时发生消去反应生成乙烯,反应的化学方程式为C2H5OH ![]() CH2=CH2↑+ H2O;乙醇与浓硫酸的混合液共热的温度控制在140℃,乙醇分子间脱去一个水分子,反应生成的是乙醚,所以制备乙烯实验中,要尽可能迅速地把反应温度提高到170 ℃左右,减少副产物乙醚生成,故答案为:C2H5OH
CH2=CH2↑+ H2O;乙醇与浓硫酸的混合液共热的温度控制在140℃,乙醇分子间脱去一个水分子,反应生成的是乙醚,所以制备乙烯实验中,要尽可能迅速地把反应温度提高到170 ℃左右,减少副产物乙醚生成,故答案为:C2H5OH ![]() CH2=CH2↑+ H2O;消去反应;b;
CH2=CH2↑+ H2O;消去反应;b;
(2)浓硫酸具有强氧化性,将乙醇氧化成二氧化碳,自身被还原成二氧化硫,二氧化碳、二氧化硫能和氢氧化钠溶液反应,故答案为:c;
(3)乙烯和溴水发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷为无色,所以装置D中实验现象为溴的颜色完全褪去,故答案为:溴的颜色完全褪去;
(4)1,2-二溴乙烷和水不互溶,1,2-二溴乙烷密度比水大,所以加水,振荡后静置,产物应在下层,故答案为:下;
(5)溴在常温下,易挥发,乙烯与溴反应时放热,溴更易挥发,冷却可避免溴的大量挥发,故答案为:避免溴大量挥发。


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
【题目】白磷有剧毒,白磷中毒可用硫酸铜溶液解毒,白磷与硫酸铜可以发生如下两个反应:
(1)2P+5CuSO4+8H2O![]() 5Cu+2H3PO4+5H2SO4
5Cu+2H3PO4+5H2SO4
(2)11P+15CuSO4 +24H2O![]() 5Cu3P+6H3PO4+15H2SO4
5Cu3P+6H3PO4+15H2SO4
下列有关说法中错误的是( )
A. 上述两个反应中,水既不是氧化剂也不是还原剂
B. 上述两个反应中,氧化剂都只有硫酸铜
C. 上述两个反应中,氧化产物都是H3PO4
D. 反应(2)中,1molCuSO4可氧化1/5molP
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:

请根据操作流程回答下列问题:
(1)操作①在加热时应选择___盛装混合物(填仪器名称)。
(2)进行操作②后,判断SO42已沉淀完全的方法是___。
(3)操作③的化学方程式为___。
(4)操作④的目的是___。
(5)实验室进行操作⑤的具体步骤是___。
(6)某同学欲用制得的氯化钠固体配制100mL0.2molL1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、__、__。
②下列操作会使所配氯化钠溶液浓度偏小的是___(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某超市违规出售的一种鸡蛋为“橡皮蛋”,煮熟后蛋黄韧性胜过乒乓球,但经检测为真鸡蛋。专家介绍,这是由于鸡饲料里添加了棉籽饼,从而使鸡蛋里含有过多棉酚所致。棉酚的结构简式如图所示。下列说法不正确的是

A. 该化合物的分子式为C30H30O8
B. 既能与FeCl3发生显色反应,也能和NaHCO3反应放出CO2
C. 1 mol棉酚最多可与6 mol NaOH反应
D. 该物质可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A用质谱仪测定如图1,核磁共振氢谱示意图如图2,则A的结构简式可能为( )

A. C2H5OHB. CH3CH2CHO
C. CH3OCH3D. CH3CH2CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条退色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨形成的原理之一可表示如下,请回答下列问题。
![]()
(1)A的化学式为__________,B的化学式为_________。
(2)三个反应中,不属于氧化还原反应的是________(填序号)。
(3)SO2中硫元素显+4价,它可以降低到0价,利用这一性质可在工厂的烟道气中通入合适的________(填“氧化剂”或“还原剂”)除去SO2,达到减少污染的目的。
(4)已知pH=-lgc(H+),经测定某次雨水所含酸性物质只有硫酸,且其浓度为5×10-5mol·L-1,则这次降雨________(填“是”或“不是”)酸雨。
(5)为了除去有害的SO2气体,在英国进行了一个研究,结果表明:高烟囱可以有效降低地面SO2的浓度。在20世纪60年代到70年代,由发电厂排放的SO2增加了35%,但由于高烟囱的建造,地面SO2浓度降低了30%之多。
①你认为减少酸雨产生可采取的措施是__________(填字母)。
A.少用煤作燃料 B.把工厂的烟囱建高
C.燃料脱硫 D.把工厂迁移到农村 E.开发新能源
②请从全球环境保护的角度,分析这种建高烟囱的方法是否可取?________(填“可取”或“不可取”),理由是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com