
����Ŀ������������ˮ��Ӧ��μӷ�̪����̪�ȱ�����ɫ��ijС����̽����ԭ��������ʵ��:��ȡ��Ӧ����Һ����������̺�Ѹ�ٲ�������������ʵ���������к�ɫ������ȥ�����з����������

A. ����������ˮ��Ӧ����������ΪO2
B. ����������ˮ��Ӧ��ҪMnO2������
C. ʵ��������֤��ʹ��̪��ɫ�IJ����������ƺ�����
D. ����������ˮ��Ӧ���������˾���Ư���Ե�H2O2
 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴ӦN2��g��+3H2��g��2NH3��g����H��0�������о�Ŀ�ĺ�ʾ��ͼ������ǣ� ��
A | B | C | D | |
�о�Ŀ�� | ѹǿ�Է�Ӧ��Ӱ�죨P2��P1�� | �¶ȶԷ�Ӧ��Ӱ�� | ƽ����ϵ����N2�Է�Ӧ��Ӱ�� | �����Է�Ӧ��Ӱ�� |
ͼʾ |
|
|
|
|
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������н��з�Ӧ��X��g��+3Y��g��2Z��g�����й�����ͼ���˵����ȷ���ǣ� ��
A.����ͼa���ж�����ӦΪ���ȷ�Ӧ
B.��ͼb�У����߿ɱ�ʾѹǿ����
C.������Ӧ�ġ�H��0��ͼc�ɱ�ʾ�����¶�ʹƽ�����淴Ӧ�����ƶ�
D.��ͼd������ƽ����Է����������¶ȵı仯���������֪����Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ŷ�CO2����ɡ�����ЧӦ����Ϊ�˼���úȼ�նԻ�����ɵ���Ⱦ��ú�������Ǹ�Ч���������ú̿����Ҫ;����ú�ۺ����õ�һ��;����ͼ��ʾ�� 
��1����֪C��s��+H2O��g���TCO��g��+H2��g����H1=+131.3kJmol��1 �� C��s��+2H2O��g���TCO2��g��+2H2��g����H2=+90kJmol��1 �� ��һ����̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽ�� ��
��2������ͼԭ���װ�ÿ�����ɹ��̢ݵ�ת������װ��b�缫�ĵ缫��Ӧʽ�� �� 
��3����ѹǿΪ0.1MPa�����£��ݻ�ΪV L���ܱ�������a mol CO��2a mol H2�ڴ��������·�Ӧ���ɼ״���CO��g��+2H2��g��CH3OH��g����CO��ƽ��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ���� ��p1p2�����������������=������
���������������������£���������������a mol CO��2a mol H2 �� �ﵽ��ƽ��ʱ��CO��ƽ��ת���������������С�����䡱���� 
����p1�£�100��ʱ��CO��g��+2H2��g��CH3OH��g����Ӧ��ƽ�ⳣ��Ϊ���ú�a��V�Ĵ���ʽ��ʾ����
��4������ͼ��ʾCO2��H2��Ӧ����CH3OH��H2O�Ĺ�������������λΪkJmol��1���ı仯�� ���ڸ÷�Ӧ������˵���У���ȷ���������ţ���
A.��H��0����S��0
B.��H��0����S��0
C.��H��0����S��0
D.��H��0����S��0
��5��Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1L���ܱ������У�����1mol CO2��3mol H2 �� һ�������·�����Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g�������CO2��g����CH3OH��g����Ũ����ʱ��仯��������ͼ��ʾ�� �ٴӷ�Ӧ��ʼ��ƽ�⣬CO2��ƽ����Ӧ����v��CO2��= ��
�����д�ʩ����ʹ��ѧƽ��������Ӧ�����ƶ����������ţ���
A�������¶�
B����CH3OH��g����ʱҺ���Ƴ�
C��ѡ���Ч����
D���ٳ���1mol CO2��3mol H2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�2���绯ѧװ�õ�������ȷ���ǣ� �� 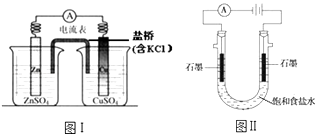
A.ͼ�����γɵ����������ǣ�����Zn��2e���TZn2+ �� ���Ӿ�������������������Cu2++2e���TCu
B.ͼ���ڲ��ı��ܷ�Ӧ��ǰ���£�����Na2SO4�滻ZnSO4 �� ��ʯī�滻Cu��
C.ͼ��ͨ���H+��Na+�ȴ��������ƶ���������Ȼ�������ŷ�����Ӧ2H++2e���TH2��
D.ͼ��ͨ�������OH��������Ǩ�ƣ�������������pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ĵ���ƽ��������ͼ��ʾ�� 
��1������A���ʾ25��ʱˮ����ƽ��ʱ���ӵ�Ũ�ȣ����¶����ߵ�100��ʱ��ˮ�ĵ���ƽ��״̬�䵽B�㣨�������궼��10��6 �� �����ʱˮ�����ӻ����䵽 �� ���ˮ�����ӻ��仯��ԭ���� ��
��2����֪25��ʱ��0.1L 0.1molL��1��NaA��Һ��pH=10����NaA��Һ�������ڵ����ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ
��3��25��ʱ����pH=11��NaOH��Һ��pH=4��������Һ��ϣ������û����ҺpH=9����NaOH��Һ��������Һ�������Ϊ ��
��4��100��ʱ����10�����ijǿ����Һ��1�����ijǿ����Һ��Ϻ���Һ�����ԣ�����֮ǰ����ǿ���pH��ǿ���pH֮��Ӧ����Ĺ�ϵ��
��5������25��ʱpH=2���������ߵ�100��ʱpH=����25��ʱpH=12NaOH���ߵ�100��ʱpH= ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йؽ����Ƶ�˵����ȷ����
A.�ܶȱ�ˮ��
B.�������ױ���������
C.����ˮ��Ӧ�ų�����
D.������ú���У�ʵ��ʣ��Ľ����Ʋ��ܷŻ�ԭƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ��
��SO2+H2O=H2SO3 ��C+H2O=H2+CO
��2Al+6H+=2Al3++3H2�� ��2Mg+CO2![]() 2MgO+C
2MgO+C
��2Na2O2+2H2O=4NaOH+O2�� ��Ca2C2+2H20=Ca(OH)2+C2H2��
��1��������Ӧ�в�����������ԭ��Ӧ����_________(�����Ӧ����ţ���ͬ)����Ӧ����H2O����ԭ����_______����ԭ����Ϊ���ʵ���_______��
��2����������Ӧ���漰���������У�����������ʵ���______(�ѧʽ)��
��3���õ����ű�ʾ��Ӧ���е���ת�Ƶķ������Ŀ___________________��
��4���������(K2FeO4)��Һ���Ϻ�ɫ�������м�������������ƣ���Һ�Ϻ�ɫ����ȥ�����ֺ��ɫ��������Һ��pH��������д���÷�Ӧ�����ӷ���ʽ__________________��
��5�������������������Ϊ���ʣ���д��ȥ��������������Һ����ֻ���ú�����Ԫ�ص��Լ������������ɿأ�����д����Ӧ�����ӷ���ʽ��
��Fe2O3(SiO2) �Լ�________��________________________________________��
��Na2CO3(NaAlO2) �Լ�________��________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ư�۵���Ҫ�ɷ���CaCl2�ͣ� ��
A.Ca��ClO3��2
B.Ca��ClO��2
C.NaClO
D.NaHCO3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com