
【题目】下列图示装置所表示的实验中,没有发生氧化还原反应的是
|
|
|
|
A.蘸有浓盐酸和浓氨水的玻璃棒靠近 | B.铝丝伸入硫酸铜溶液中 | C.测定空气中氧气含量 | D.向蔗糖中加入浓硫酸 |
A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】某溶液A中可能只含有K+、Fe3+、Cu2+、Fe2+、Ag+、Mg2+、Al3+、NH4+、Cl-、NO3-、SO42-中的若干种,为检验确认其中所含的各离子,取1L溶液A,进行如下实验:

已知气体A、B的体积都为2.24L(标况下),沉淀B的物质的量为0.1mol,根据以上实验操作与现象,有关于该溶液的结论正确的是:
A.溶液A中肯定存在Fe2+、Ag+、Mg2+、NO3-
B.溶液A中一定不含Al3+
C.溶液A中可能含有Cu2+、Cl-
D.溶液A中c(NO3-)≥1.0mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是![]()
![]()
A.煤的气化就是把煤转化为可燃性气体的过程。在高温下,煤和水蒸气作用得到CO、![]() 、
、![]() 等气体
等气体
B.糖类、油脂、蛋白质在一定条件下均能水解
C.向蛋白质溶液中加入饱和硫酸钠溶液,先产生白色沉淀,加水后又重新溶解
D.淀粉溶液中滴加硫酸,加热水解后,往水解液中滴加![]() 滴新制氢氧化铜,加热,无红色沉淀出现,原因可能是硫酸未完全被中和
滴新制氢氧化铜,加热,无红色沉淀出现,原因可能是硫酸未完全被中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种化合物,分别由K+、Ba2+、SO42—、CO32、OH—中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊。
(1)推断A、B、C、D的化学式。
A、________,B、________,C、________,D、________。
(2)写出下列反应的离子方程式。
B与盐酸反应:_______________________________________________,
C与硫酸反应:_______________________________________________,
E(少量)与澄清石灰水反应:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烷脱氢制异丁烯反应为:![]()
副反应为裂解反应:![]()
![]() 已知:
已知:
化学键 | | | | |
键能 | 412 | 348 | 612 | 436 |
试计算异丁烷脱氢反应的![]() ______
______![]()
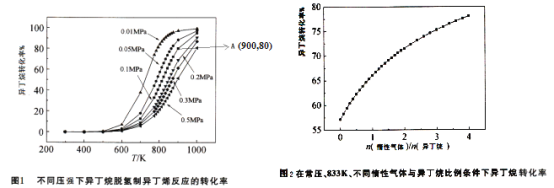
![]() 不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
A.主反应和副反应均在低温条件下自发
B.开发高选择性的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
C.由图1可知,![]() 范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
D.选择合适的温度,使催化剂的活性最大,有利于提高异丁烷的平衡转化率
![]() 平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替
平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替![]() 分压
分压![]() 物质的量分数
物质的量分数![]() 总压强
总压强![]() 。图1中,A点状态下的异丁烷脱氢反应的平衡常数
。图1中,A点状态下的异丁烷脱氢反应的平衡常数![]() ______
______![]() 保留两位有效数字
保留两位有效数字![]() 。
。
![]() 常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
![]() 请在图2中画出温度为
请在图2中画出温度为![]() ,其他条件不变时,异丁烷转化率图象。
,其他条件不变时,异丁烷转化率图象。
![]() 科学家发现,以
科学家发现,以![]() 和
和![]() 为原料,熔融
为原料,熔融![]() 为电解质,纳米
为电解质,纳米![]() 作催化剂,在
作催化剂,在![]() 和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和
和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以一种工业废渣![]() 主要成分为
主要成分为![]() 、
、![]() 和少量Fe、Cu的氧化物
和少量Fe、Cu的氧化物![]() 为原料制备
为原料制备![]() 实验过程如下:
实验过程如下:

![]() 酸溶过程中,
酸溶过程中,![]() 发生的化学方程式为______。
发生的化学方程式为______。
![]() 加入
加入![]() 的作用为______。
的作用为______。
![]() 下列关于分液漏斗及其使用方法的叙述,正确的是______
下列关于分液漏斗及其使用方法的叙述,正确的是______![]() 。
。
A 使用前要先检查玻璃塞和旋塞处是否漏液
B 将加入有机萃取剂后的混合液转移到分液漏斗中,塞上玻璃塞,用右手压住分液漏斗玻璃塞,左手握住旋塞,倒转漏斗,用力振荡,并不时旋开旋塞放气
C 分液时,必须塞紧上口玻璃塞,保证密封,以防止有机萃取剂挥发
D 本实验中,含![]() 的有机相一定从下口放出,水层从上口倒出
的有机相一定从下口放出,水层从上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“硫代硫酸银”( [ Ag(S2O3)2]3–)常用于切花保鲜,由AgNO3溶液(0.1 mol·L–1 、pH=6)和Na2S2O3溶液(0.1 mol·L–1、pH=7)现用现配制。某小组探究其配制方法。
(实验一)

(1)A为Ag2S2O3。写出生成A的离子方程式__________。
(2)对实验现象的分析得出,试管a中充分反应后一定生成了__________(填离子符号)。进而推测出沉淀m可能为Ag2S、Ag、S或它们的混合物。做出推测的理由是__________。
(3)若试管a中物质充分反应后不过滤,继续加入1.1 mL Na2S2O3溶液,振荡,静置,黑色沉淀不溶解,清液中逐渐出现乳白色浑浊,有刺激性气味产生。用离子方程式解释产生白色浑浊的原因:__________。
结论:Ag2S2O3不稳定,分解所得固体不溶于Na2S2O3溶液。
(实验二)已知:Ag2S2O3 +3S2O32- ![]() 2 [ Ag(S2O3)2]3–(无色)
2 [ Ag(S2O3)2]3–(无色)
实验操作 | 实验现象 |
i. | 白色沉淀生成,振荡后迅速溶解,得到无色清液; 滴加至约1 mL时清液开始略显棕黄色,有丁达尔现象; 超过1.5 mL后,产生少量白色沉淀,立即变为棕黄色,最终变为黑色; 滴加完毕,静置,得到黑色沉淀,上层清液pH = 5 |
ii. | 白色沉淀生成,立即变为棕黄色,充分振荡后得到棕黄色清液,有丁达尔现象。 |
(4)用平衡移动原理解释实验i中加入1.5 mL AgNO3后产生白色沉淀的原因:__________。
(5)实验i中,当加入0.5 mL AgNO3溶液时,得到无色清液,若放置一段时间,无明显变化。结合化学反应速率分析该现象与ii不同的原因是__________。
(6)简述用0.1 mol·L–1 AgNO3溶液和0.1 mol·L–1 Na2S2O3溶液配制该保鲜剂时,试剂的投料比和操作:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是

A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com