
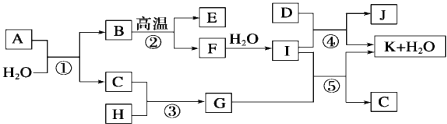
分析 图中各物质是由1~20号元素中部分元素组成的单质或其化合物,D是一种黄绿色的气体单质,则D为Cl2,物质J可用于饮水消毒,反应④是化工生产中的重要反应,应是工业制备漂白粉原理,则I为Ca(OH)2、J为Ca(ClO)2、K为CaCl2,C是无色有刺激性气味的气体,反应⑤是实验室制备气体C,结合反应物与生成可知,为制备氨气的反应,故C为NH3、G为NH4Cl,结合转化关系可知H为HCl.F与水反应生成Ca(OH)2,则F为CaO,反应②是化工生产中的重要反应,为碳酸钙高温分解反应,故B为CaCO3、E为CO2.物质A由三种元素组成,1molA与水反应可生成1molB(CaCO3)和2molC(NH3),根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,据此解答.
解答 解:图中各物质是由1~20号元素中部分元素组成的单质或其化合物,D是一种黄绿色的气体单质,则D为Cl2,物质J可用于饮水消毒,反应④是化工生产中的重要反应,应是工业制备漂白粉原理,则I为Ca(OH)2、J为Ca(ClO)2、K为CaCl2,C是无色有刺激性气味的气体,反应⑤是实验室制备气体C,结合反应物与生成可知,为制备氨气的反应,故C为NH3、G为NH4Cl,结合转化关系可知H为HCl.F与水反应生成Ca(OH)2,则F为CaO,反应②是化工生产中的重要反应,为碳酸钙高温分解反应,故B为CaCO3、E为CO2.物质A由三种元素组成,1molA与水反应可生成1molB(CaCO3)和2molC(NH3),根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,
(1)反应⑤是实验室制备氨气,反应方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)物质A由三种元素组成,1molA与水反应可生成1molCaCO3和2molNH3,根据元素守恒可知A含有Ca、C、N三种元素,由原子守恒可知,A的化学式为CaCN2,
故答案为:CaCN2;
(3)CaCN2与水生成CaCO3和 NH3的化学方程式为CaCN2+3H2O=CaCO3+2NH3,
故答案为:CaCN2+3H2O=CaCO3+2NH3;
(4)C为NH3,C的催化氧化产物为L和M,M继续氧化后的产物N遇到L生成一种工业强酸,则M为NO,L为水,N为NO2,二氧化氮与水生成硝酸,.硝酸铅受热分解(Pb为+2价,分解前后铅的化合价不变),受热分解的化学方程式为2Pb(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2PbO+4NO2↑+O2↑,检验放出的气体,当发现木条复燃时该学生断言该铅盐受热分解有氧气放出,该结论不合理,因为在混合气体中氧气占五分之,不一定能使本条复燃,另外二氧化氮也有氧化性,也可能使本条复燃,所以应先将混合气体通过氢氧化钠溶液中除去二氧化氮,再用带火星的本条检验,
故答案为:2Pb(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2PbO+4NO2↑+O2↑;不合理,因为在混合气体中氧气占五分之,不一定能使本条复燃,另外二氧化氮也有氧化性,也可能使本条复燃,所以应先将混合气体通过氢氧化钠溶液中除去二氧化氮,再用带火星的本条检验;
(5)M为NO,N为NO2,将含等物质的量的 M和 N的混合物溶解在接近零度的水中,即生成一种弱酸的水溶液应为亚硝酸,亚硝酸根离子和铝、氢氧根离子反应生成偏铝酸根离子和氨气,离子反应方程式为2Al+NO2-+OH-+H2O=2AlO2-+NH3↑,
故答案为:2Al+NO2-+OH-+H2O=2AlO2-+NH3↑.
点评 本题考查无机物的推断,“D是黄绿色气体单质”是突破口,结合J的用途与中学常见的重要化工反应进行推断,侧重学生对元素化合物知识的熟练掌握考查,难度中等.


科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | R | |
| W |
| A. | 五种元素的原子最外层电子数一定大于2 | |
| B. | 五种元素一定都是非金属元素 | |
| C. | R 的最高价氧化物对应的水化物一定是强酸 | |
| D. | X的氢化物沸点一定比Z的氢化物沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题:
E、G、M、Q、T是五种原子序数依次增大的前四周期元素.E、G、M是位于p区的同一中期的元素,M的价电子排布为nsnnp2n,E、M的原子核外的未成对电子数相等;M、Q同主族,QM2与GM2-具有相等的价电子总数;T为过渡元素,去原子核外没有成对电子.请回答下列问题: (若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.
(若有配位键,请用“→”表示).E、M电负性相差1.0,由此可以判断EM应该为极性较强的分子,但实际上EM分子的极性极弱,请解释其原因:从电负性分析,CO中的共用电子对偏向氧原子,但分子中形成配位键的电子对是由氧原子单方面提供的,抵消了共用电子对偏向O而产生的极性.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | |||
| Y | Z | W | A |
| T | B |
| A. | Y、Z、W、A元素性质均较为活泼,但其中Y、W在自然界中存在游离态的形式,它们的最高价氧化物的水化物的酸性依次递增 | |
| B. | X、W、Z元素的原子半径与它们的气态氢化物的热稳定性变化趋势相反 | |
| C. | 工业上电解A的钠盐溶液可以得到多种产物,为防止产物互相反应常使用阳离子交换膜,其阴极反应式为:2H2O+2e-=2OH-+H2↑ | |
| D. | 根据元素周期律,可以推测T元素的单质具有半导体特性,T2W3具有氧化性和还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
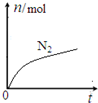 某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:
某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示: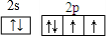 ,该化学用语不能表达出氧原子最外层电子的c(填序号).
,该化学用语不能表达出氧原子最外层电子的c(填序号).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 部分卤代烃可用作灭火剂 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的种类由原子核内质子数、中子数决定 | |
| B. | 元素的种类由原子核内质子数、中子数决定 | |
| C. | 32He代表原子核内有2个质子和3个中子的氦原子 | |
| D. | 178O和188O原子的核外电子数是前者大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com