
| A. | NH4Cl?NH4++Cl- | B. | H2S?2H++S2- | ||
| C. | K2CO3?2K++CO32- | D. | CH3COONH4=NH4++CH3COO- |
分析 A.氯化铵为强电解质,完全电离,完全电离用“=”连接;
B.氢硫酸为弱电解质,多元弱酸应分步电离;
C.碳酸钾属于盐,属于强电解质,完全电离,完全电离用“=”连接;
D.乙酸铵属于强电解质,完全电离出铵根离子和乙酸根离子.
解答 解:A.氯化铵属于盐,完全电离出铵根离子和氯离子,电离方程式为:NH4Cl=NH4++Cl-,故A错误;
B.H2S是二元弱酸,属弱电解质,分两步电离,第一步电离出氢离子和硫氢根离子,第二步电离:硫氢根离子电离出硫离子和氢离子,H2S?H++HS-,HS-?H++S2-,故B错误;
C.碳酸钾属于盐,属于强电解质,完全电离,电离方程式为:K2CO3=2K++CO32-,故C错误;
D.乙酸铵属于强电解质,完全电离,电离方程式为:CH3COONH4=NH4++CH3COO-,故D正确;
故选D.
点评 本题考查了电离方程式的书写判断,掌握正确书写电离方程式的方法,并会正确判断电离方程式的正误是解题的关键,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | Fe2O3是氧化剂 | |
| B. | Na2FeO4既是氧化产物又是还原产物 | |
| C. | 生成1mol Na2FeO4时,有3mol电子转移 | |
| D. | Na2FeO4能杀菌消毒是利用Na2FeO4中+6价铁的强还原性被还原为Fe3+,净水是利用Fe3+在水中产生Fe(OH)3胶体从而吸附水中的悬浮颗粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | |
| 浓度1 | 0.05mol•L-1 | a mol•L-1 | 0.05mol•L-1 |
| 浓度2 | 0.078mol•L-1 | 0.078mol•L-1 | 0.022mol•L-1 |
| 浓度3 | 0.06mol•L-1 | 0.06mol•L-1 | 0.04mol•L-1 |
| 浓度4 | 0.07mol•L-1 | 0.07mol•L-1 | 0.098mol•L-1 |
| A. | 由[浓度3]与[浓度1]的比较,可判断平衡移动的原因是增大了体系的压强 | |
| B. | 由[浓度2]与[浓度1]的比较,可判断正反应是放热反应 | |
| C. | [浓度1]中a=0.05 | |
| D. | 该组某学生在实验①过程中,测得各物质在某一时刻的浓度为[浓度4].与[浓度1]比较,可发现该同学在测定[浓度4]这组数据时出现了很大的误差 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
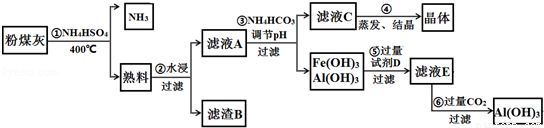
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
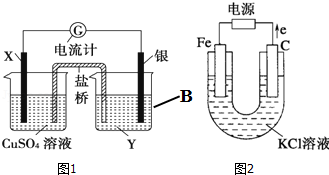
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
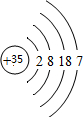 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | 灼热的木炭与CO2的反应 | |
| C. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| D. | 甲烷在空气中燃烧的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
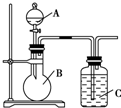 某同学设计如图装置,研究非金属元素性质变化规律.
某同学设计如图装置,研究非金属元素性质变化规律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
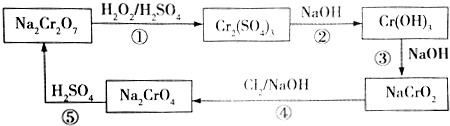
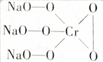 ,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.
,则Cr的化合价为+5,其中含有的化学键有离子键、共价键.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com