
分析 在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,平衡状态下存在溶度积常数,依据平衡影响因素分析平衡的变化,
(1)加入AgNO3固体,使c(Ag+)增大,AgI溶解平衡向左移动;
(2)改加更多的AgI固体,仍是该温度下的饱和溶液;
(3)因AgBr的溶解度大于AgI的溶解度,改加AgBr固体时,使c(Ag+)变大.
解答 解:在一定温度下,向AgI的饱和溶液中存在沉淀溶解平衡,AgI(s)?Ag+(aq)+I-(aq),平衡状态下存在溶度积常数,Ksp=C(Ag+)•C(I-);
(1)若加入AgNO3固体,会增加银离子浓度,沉淀溶解平衡AgI(s)?Ag+(aq)+I-(aq),左移,c(I-)减小,
故答案为:变小;
(2)若加入更多的AgI固体,沉淀溶解平衡AgI(s)?Ag+(aq)+I-(aq)不移动,则c(Ag+)不变,
故答案为:不变;
(3)若加入固体AgBr,AgBr的溶解性大于AgI,所以平衡状态下AgBr溶液中的银离子浓度大于AgI溶液中的银离子浓度,使c(Ag+)变大,所以碘化银沉淀溶解平衡左移,c(I-)减小,
故答案为:变小;变大;
点评 本题考查了沉淀溶解平衡的分析判断和应用,主要是分析沉淀溶解平衡的影响因素的分析判断平衡移动的方向,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | S2-+2H2O?H2S+2OH- | B. | CH3COO-+H2O?CH3COOH+OH- | ||
| C. | CH3COOH+H2O?CH3COO-+H3O+ | D. | Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在电解池中阴离子向阳极移动;在原电池中阴离子向正极移动 | |
| B. | 在电解池中,阳极发生氧化反应,在原电池中,负极发生氧化反应 | |
| C. | 电解池的阳极与电源的正极相连 | |
| D. | 电解过程中,电子从电源的负极流出到达阴极,从阳极流出回到电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度和减小压强 | B. | 降低温度和减小压强 | ||
| C. | 降低温度和增大压强 | D. | 升高温度和增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2SO4溶液 | B. | MgCl2溶液 | C. | NaHCO3溶液 | D. | CuSO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
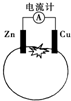
| A. | 一段时间后,锌片质量会变少 | B. | 铜电极附近会出现蓝色 | ||
| C. | 电流由铜通过导线流向锌 | D. | 锌电极是该电池的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔融烧碱时,不能使用普通石英坩埚:SiO2+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SiO3+H2O | |
| B. | 向Na2SO3、NaI的混合溶液中滴加少量氯水:2I-+C12═2 Cl-+I2 | |
| C. | 红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe3O4+4H2 | |
| D. | “84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分HCl)混合使用放出氯气:ClO-+Cl-+2H+═Cl2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | 用两根铜棒电解稀盐酸:2H++2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O+4H+═SO42-+3S↓+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com