
分析 (1)①铵根离子与氢氧根离子反应是NH3•H2O;
②二氧化碳与氢氧化钙反应生成碳酸钙沉淀;
③三氧化二铁和盐酸反应生成氯化铁和水;
(2)①可溶性碳酸盐与可溶性钡盐反应生成碳酸钡和可溶性盐的离子反应为CO32-+Ba2+=BaCO3↓;
②Fe与可溶性铜盐反应生成Cu和可溶性亚铁盐的离子反应为Cu2++Fe=Cu+Fe2+.
解答 解:(1)①铵根离子与氢氧根离子反应是NH3•H2O,其反应的离子方程式为:NH4++OH-=NH3•H2O;
故答案为:NH4++OH-=NH3•H2O;
②二氧化碳与氢氧化钙反应生成碳酸钙沉淀,其反应的离子方程式为:CO2+Ca2++2OH-=CaCO3↓+H2O;
故答案为:CO2+Ca2++2OH-=CaCO3↓+H2O;
③三氧化二铁和盐酸反应生成氯化铁和水,其反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O;
故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)①可溶性碳酸盐与可溶性钡盐反应生成碳酸钡和可溶性盐的离子反应为CO32-+Ba2+=BaCO3↓,如:Na2CO3+BaCl2=BaCO3↓+2NaCl,
故答案为:Na2CO3+BaCl2=BaCO3↓+2NaCl;
②Fe与可溶性铜盐反应生成Cu和可溶性亚铁盐的离子反应为Cu2++Fe=Cu+Fe2+,如:Fe+CuCl2=Cu+FeCl2,
故答案为:Fe+CuCl2=Cu+FeCl2.
点评 本题考查离子反应方程式的书写,为高考常见题型,侧重量有关的离子反应的考查,明确发生的化学反应及离子反应的书写方法即可解答,题目难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂 | B. | 矿物质 | C. | 蛋白质 | D. | 维生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2nmol-1 | B. | $\frac{n}{m}$mol-1 | C. | $\frac{2n}{m}$mol-1 | D. | nmol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
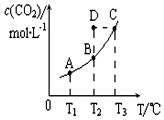 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )| A. | 在T2时,若反应进行到状态D,则一定有v正<v逆 | |
| B. | 平衡状态A与C相比,平衡状态A的c(CO)小 | |
| C. | 若T1、T2时的平衡常数分别为K1、K2,则K1<K2 | |
| D. | 反应CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中导电粒子的数目减少 | |
| B. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)c(O{H^-})}}$不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com