
分析 (1)锰元素的最高价是+7价,根据化合价规则书写化学式,可以和碱反应生成盐和水的氧化物属于酸性氧化物;
(2)用电解锰酸钾(K2MnO4)溶液的方法制备KMnO4,在阴极上发生还原反应,阳极上发生氧化反应;
(3)以NaBH4和H2O2为原料的燃料电池中,双氧水得电子发生还原反应,负极上BH4-得电子和氢氧根离子反应生成BO2-,二氧化锰可作双氧水的催化剂;
(4)①软锰矿制备K2MnO4的反应物是MnO2、6KOH和KClO3,反应条件是加热,生成物是3K2MnO4、KCl和3H2O;
②利用化学反应方程式及二氧化锰的质量代入计算.
解答 解:(1)锰元素的最高价是+7价,Mn的最高价氧化物的化学式为Mn2O7,Mn2O7可以和碱反应生成盐和水,属于酸性氧化物,故答案为:Mn2O7;酸性;
(2)用电解锰酸钾(K2MnO4)溶液的方法制备KMnO4,在阴极上发生还原反应,2H++2e-=H2↑,阳极上发生氧化反应;MnO42--e-=MnO4-;
故答案为:H2;MnO42--e-=MnO4-;
(3)电极MnO2为正极,H2O2发生还原反应,负极发生氧化反应生成BO2-,电极反应式为BH4-+8OH--8e-=BO2-+6H2O,MnO2既作电极材料又有催化作用;
故答案为:作催化剂;BH4-+8OH--8e-=BO2-+6H2O;
(4)①熔融的软锰矿与过量固体KOH反应在不断通入空气的情况下会反应生成K2MnO4(锰酸钾),则反应为2MnO2+4KOH+O2=2K2MnO4+2H2O,故答案为:2MnO2+4KOH+O2=2K2MnO4+2H2O;
②由2MnO2+4KOH+O2=2K2MnO4+2H2O、3MnO42-+4H+═MnO2↓+2MnO4-+2H2O可知,反应物和生成物间的计量关系为:
MnO2→K2MnO4→$\frac{2}{3}$KMnO4
87 158×$\frac{2}{3}$
5×70% x
x=4.24,故答案为:4.24.
点评 本题考查电极反应方程式的书写及有关氧化还原反应的计算,明确反应物与生成物及物质之间的关系是解答的关键,其中(4)计算是本题难点,整体难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
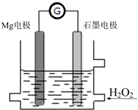 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 石墨电极是该电池的正极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-=Mg2+ | |
| D. | 电池工作时,电子从Mg电极经导线流向石墨电极,再出石墨电极经电解质溶液流向Mg电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-═3Fe3++NO↑+4H2O | |
| D. | 将0.4 mol•L-1的NaAlO2溶液和0.7 mol•L-1的盐酸等体积混合:4AlO${\;}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
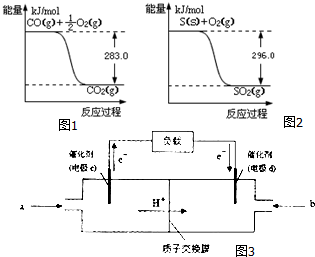 一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资
一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资查看答案和解析>>
科目:高中化学 来源: 题型:选择题
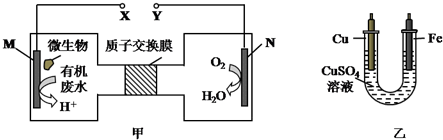
| A. | H十透过质子交换膜由左向右移动 | |
| B. | 铜电极应与Y相连接 | |
| C. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

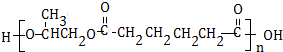 .
.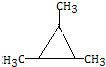 .
.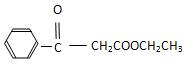
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
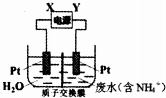
| A. | 直流电源中X为负极 | |
| B. | 阳极反应为2NH4+-6e-=N2↑+8H+ | |
| C. | 阴极反应为2H2O+2e-=H2↑+2OH- | |
| D. | 当有6mol电子转移时,质子交换膜两侧电解质溶液质量变化差为32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
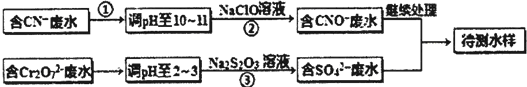
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com