
【题目】绿矾(FeSO4 7H2O)是治疗缺铁性贫血的特效药.下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法: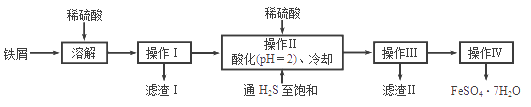
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH 为3.0,沉淀完全时的pH为5.5:
回答下列问题:
(1)操作Ⅱ中用硫酸酸化至pH=2且通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②;
(2)操作IV的顺序依次为:、、过滤、洗涤。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;②。
(4)测定绿矾产品中Fe2+ 含量的方法是:a.称取8.680g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.02000 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为30.00 mL(滴定时发生反应的离子方程式为:5Fe2+ + MnO4- + 8H+ ═ 5Fe3+ + Mn2+ + 4H2O)
①计算上述样品中FeSO4 7H2O的质量分数为(结果保留4位有效数字,FeSO4 7H2O的摩尔质量为278g/mol)
②若用上述方法测定的样品中FeSO47H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有:样品中存在少量的杂质、
【答案】
(1)硫化氢具有强还原性,可以防止亚铁离子被氧化
(2)蒸发;浓缩、结晶
(3)避免绿矾溶解带来的损失
(4)![]() ;洗涤不彻底,亚铁离子被空气中的氧气部分氧化。
;洗涤不彻底,亚铁离子被空气中的氧气部分氧化。
【解析】(1)已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5,操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是,在溶液pH=2时,Sn2+完全沉淀,亚铁离子不沉淀,通入硫化氢至饱和的目的是:硫化氢具有强还原性,可以防止亚铁离子被氧化;
(2)溶液中得到晶体,需要对溶液进行加热蒸发浓缩,结晶析出,过滤洗涤等,所以操作IV的顺序依次为:蒸发浓缩、结晶、过滤、洗涤;
(3)冰水温度低,物质溶解度减小,可以洗去沉淀表面的杂质离子,避免绿矾溶解带来的损失;
(4)①依据反应方程式可知:
5Fe2+ + | MnO4- + 8H+=5Fe3+ + Mn2+ +4H2O |
5 | 1 |
n | 0.02000mol/L×0.0300L |
解得n=0.003mol;
则250mL溶液中含亚铁离子的物质的量=0.003mol×250/25=0.03mol;
FeSO47H2O物质的量为0.03mol,质量=0.03mol×278g/mol=8.34g;
所以质量分数= ![]() ;
;
②用上述方法测定的样品中FeSO47H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因是洗涤不彻底,亚铁离子被空气中的氧气部分氧化。
所以答案是:(1)硫化氢具有强还原性,可以防止亚铁离子被氧化;(2)蒸发;浓缩、结晶;(3)避免绿矾溶解带来的损失;(4)96.08%;洗涤不彻底,亚铁离子被空气中的氧气部分氧化


科目:高中化学 来源: 题型:
【题目】据报道,化合物M对番茄灰霉菌有较好的抑菌活性,其合成路线如下图所示。


完成下列填空:
(1)写出反应类型。
反应③___________ 反应④__________
(2)写出结构简式。
A______________ E_______________________
(3)写出反应②的化学方程式________________
(4)B的含苯环结构的同分异构体中,有一类能发生碱性水解,写出检验这类同分异构体中的官能团(酚羟基除外)的试剂及出现的现象。
试剂(酚酞除外)___________ 现象________________________
(5)写出两种C的含苯环结构且只含4种不同化学环境氢原子的同分异构体的结构简式。_____________
(6)反应①、反应②的先后次序不能颠倒,解释原因。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36 g·cm-3。实验室制备少量1-溴丙烷的主要步骤如下:
步骤1:在仪器A中加入搅拌磁子、12 g正丙醇及20 mL水,冰水冷却下缓慢加入28 mL浓H2SO4;冷却至室温,搅拌下加入24 g NaBr。
步骤2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用12 mL H2O、12 mL 5% Na2CO3溶液和12 mL H2O洗涤,分液,得粗产品,进一步提纯得1-溴丙烷。
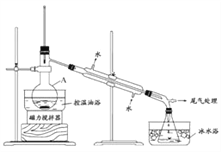
(1)仪器A的名称是_____________;加入搅拌磁子的目的是防止暴沸和___________________。
(2)反应时生成的主要有机副产物有2-溴丙烷和__________________________________。
(3)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是___________________。
(4)步骤2中需缓慢加热使反应和蒸馏平稳进行,目的是______________________________。
(5)步骤4中用5%Na2CO3溶液洗涤有机相的操作: 向分液漏斗中小心加入12 mL 5% Na2CO3溶液,振荡,____________,静置,分液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水提取溴和镁的过程如下,下列说法不正确的是( )
A.若提取1 mol Br2 , 至少需要标准状况下44.8 L的Cl2
B.工业上常利用电解熔融MgCl2冶炼金属镁
C.富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D.工业溴中含少量Cl2 , 可用NaOH溶液除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如下所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.请回答下列问题:
X | Y | |
Z | W |
(1)元素Z位于周期表中第_____周期,_____族;
(2)比较X与Y的气态氢化物的稳定性:_____(写化学式);
(3)XW2的电子式为_____;
(4)比较X、Y、Z、W四种原子半径由大到小关系:_____;
(5)X和W形成的化合物属于_____ (填“离子化合物”、或“共价化合物”),该化合物中存在的微粒间作用力有:_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列式子属于水解反应,且溶液呈酸性的是 ( )
A.HCO3- + H2O ![]() H3O+ + CO32-
H3O+ + CO32-
B.Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+
Fe(OH)3 + 3H+
C.HS- + H2O ![]() H2S + OH-
H2S + OH-
D.NH4+ + OH- ![]() NH3↑+ H2O
NH3↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(主要成份为FeO·Cr2O3,还含有Al2O3、MgO等杂质)为主要原料生产二水合重铬酸钠(Na2Cr2O7·2H2O),其主要工艺流程如下图所示。
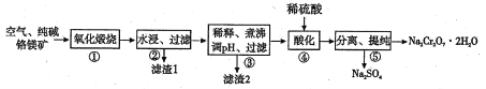
回答下列问题:
(1)二水合重铬酸钠(Na2Cr2O7·2H2O)中Cr的化合价为________________。
(2)已知:步骤①中涉及的主要反应是FeO·Cr2O3+Na2CO3+O2![]() Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
Na2CrO4+Fe2O3+CO3(未配平),该反应中氧化剂和还原剂的物质的量比为_____________。
(3)滤渣1的主要成分为MgO和_____(填化学式);滤渣2的成分是______(填物质名称)。
(4)步骤④,向滤液中加入稀硫酸,溶液由黄色变为橙色,得到Na2Cr2O7和Na2SO4的混合溶液,发生反应的离子方程式为_______________。
(5)经步骤④酸化后的溶液中获得Na2Cr2O7·2H2O晶体的操作依次是蒸发浓缩、____、过滤、洗涤、干燥。
(6)该工艺的酸性废液中含有Cr2O72-,可向废液中加入绿矾(FeSO4·7H2O)还原处理。若处理20m3的Cr2O72-酸性废液,需要绿矾166.8g,则原废液中Cr2O72-的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol·L-1盐酸滴入20.00mL 1.000mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是( )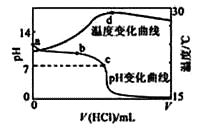
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点:c(NH4+)+c(NH3·H2O) > c(Cl-)
C.c点:反应消耗的HCl 和NH3·H2O 的关系为:n(HCl)= n(NH3·H2O)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com