
【题目】称取铁粉和氧化铜的混合物6.40g,进行如下实验:
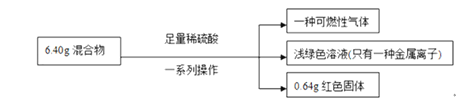
根据实验所得数据,完成下列填空:
(1)原混合物中氧化铜的质量能否确定?____________(填“能”或“不能”),若能确定,则氧化铜的质量为_________;
(2)上述过程中生成气体的名称为_________;(折算为标准状况下)的体积为__________ ;
(3)实验中参加反应的硫酸的物质的量为____________;
(4)原混合物中铁的质量分数为 ________。
【答案】 能 0.8g 氢气 2.016L 0.1mol 87.5%
【解析】生成可燃性气体,说明发生反应Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,生成0.64gCu,其物质的量: ![]() =0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
=0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
故混合物中:m(CuO)=0.01mol×80g/mol=0.8g,则:m(Fe)=6.40g-0.8g=5.6g,n(Fe)=![]() =0.1mol。(1)原混合物中氧化铜的质量能确定,氧化铜的质量为0.8g;(2)上述过程中生成气体的名称为氢气;设氢气的物质的量为nmol,根据电子转移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,(折算为标准状况下)的体积为0.09mol×22.4L/mol=2.016L;(3)实验中参加反应的硫酸最终转化为硫酸亚铁,根据质量守恒可知,其物质的量等于铁的物质的量,则为0.1mol;(4)由上述分析可知,Fe的质量为5.6g,混合物中Fe的质量分数为:
=0.1mol。(1)原混合物中氧化铜的质量能确定,氧化铜的质量为0.8g;(2)上述过程中生成气体的名称为氢气;设氢气的物质的量为nmol,根据电子转移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,(折算为标准状况下)的体积为0.09mol×22.4L/mol=2.016L;(3)实验中参加反应的硫酸最终转化为硫酸亚铁,根据质量守恒可知,其物质的量等于铁的物质的量,则为0.1mol;(4)由上述分析可知,Fe的质量为5.6g,混合物中Fe的质量分数为: ![]() ×100%=87.5%。
×100%=87.5%。


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】分别向盛有淀粉—碘溶液的两烧杯中滴加新鲜黄瓜汁和久置黄瓜汁,黄瓜汁中含有的维生素C能使淀粉—碘溶液褪色,实验结果见下表。下列说法不正确的是( )
黄瓜汁 | 新鲜 | 久置 |
滴数 | 12 | 20 |
A.维生素C具有还原性,能将碘单质还原为I-
B.实验时两烧杯中的淀粉—碘溶液的浓度和体积相等
C.新鲜黄瓜汁中比久置黄瓜汁中维生素C含量低
D.维生素C缺乏的病人要多吃新鲜的蔬菜和水果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化物的叙述正确的是( )
A. 碱性氧化物均可以和酸发生反应B. 酸性氧化物在常温下均为气态
C. 金属氧化物均是碱性氧化物D. 不能与酸反应的氧化物一定能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式RO3n-+F2+mOH-=RO4- +aF- +H2O,试推算未知数n=___,a=___,m=____,RO3n- 中元素R的化合价为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】世界卫生组织(WHO)将二氧化氯(ClO2)列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用,由此可判断二氧化氯()
A.是强氧化剂
B.是强还原剂
C.是离子化合物
D.分子中氯元素为-1价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.1 L0.6molL﹣1的食盐水中含氯化钠0.6mol
B.0.5mol碳酸钠溶于水配成0.5L溶液,所得溶液的物质的量浓度为0.5molL﹣1
C.标准状况下,44.8L氯化氢气体溶于1L水中所得溶液的物质的量浓度为2molL﹣1
D.20g氢氧化钠溶于水配成物质的量浓度为1molL﹣1的溶液,可得溶液1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将35g锌粉与少量浓硫酸在加热条件下充分反应,共收集到混合气体11.2L(标准状况),其质量为19.6g,则剩余锌粉的质量为
A. 1.0g B. 2.0g C. 2.5g D. 3.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) ![]() N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
N2(g)+CO2(g)△H=﹣373.2kJ/mol,达到平衡后,为提高该反应的速率和CO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.升高温度同时充入N2
C.加催化剂同时增大压强
D.降低温度同时减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,两个等体积的干燥圆底烧瓶中分别充满①NH3②NO2进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度为( )
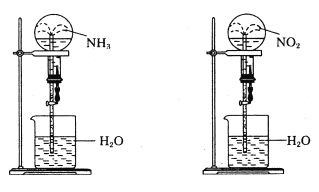
A. ①>② B. ①<② C. ①=② D. 不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com