
| A. | Cu2+、SO42-、OH-、K+ | B. | Fe3+、SCN-、Cl-、H+ | ||
| C. | K+、CO32-、Cl-、H+ | D. | H+、Na+、Cl-、SO42- |
分析 A.铁离子与氢氧根离子反应生成氢氧化铜沉淀;
B.铁离子与硫氰根离子反应;
C.碳酸根离子与氢离子反应;
D.四种离子之间不反应,能够共存.
解答 解:A.Cu2+、OH-之间发生反应,在溶液中不能大量共存,故A错误;
B.Fe3+、SCN-之间发生反应生成络合物硫氰化铁,在溶液中不能大量共存,故B错误;
C.CO32-、H+之间发生反应,在溶液中不能大量共存,故C错误;
D.H+、Na+、Cl-、SO42-之间不发生反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
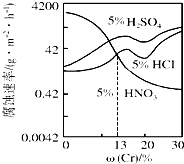 随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )
随Cr含量的变化三种稀酸对Fe-Cr合金腐蚀速率的曲线如图所示,下列有关说法正确的是( )| A. | 稀硝酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱 | |
| B. | 随着Cr含量增加,稀硝酸对Fe-Cr合金的腐蚀性减弱 | |
| C. | Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强 | |
| D. | 酸对Fe-Cr合金的腐蚀与阴离子浓度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
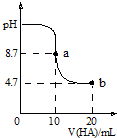 室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL0.1mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | pH=7时,c(Na+)=0.05 mol•L-1 | |
| C. | a、b两点溶液中水电离出c(H+)浓度的比值为104 | |
| D. | b点所示溶液中c(A-)<c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用大量SO2漂白银耳 | |
| B. | 用小苏打(NaHCO3)焙制糕点 | |
| C. | 硅胶常用作食品、药品干燥剂 | |
| D. | 用消毒液(有效成分NaClO)对餐具进行杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
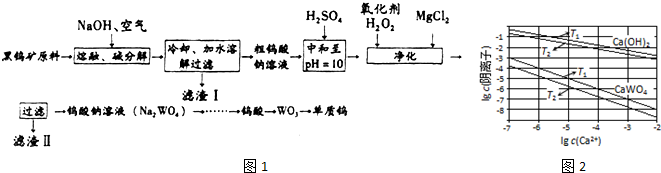
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
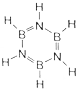 氮元素是一种常见元素,能形成多种化合物.
氮元素是一种常见元素,能形成多种化合物.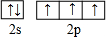 ,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.
,等物质的量的NH3和N2组成的混合气体中σ键和π键的物质之比为2:1.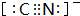 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | $\frac{4-n}{6-n}$ | C. | $\frac{n-4}{6-n}$ | D. | $\frac{1}{m}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属的冶炼方法有4种,其中铝热反应属于热分解法 | |
| B. | 海带中碘元素的检验原理:2H++2I-+H2O2=I2+2H2O | |
| C. | 石油的分馏,裂化,裂解,催化重整中裂化是物理变化 | |
| D. | 铝热反应中铝做还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com