
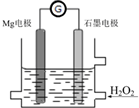
 Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )
Mg-H2O2电池是一种化学电源,以Mg和石墨为电极,海水为电解质溶液,示意图如下.下列说法不正确的是( )| A. | 镁电极是该电池的负极 | |
| B. | 石墨电极上发生还原反应 | |
| C. | Mg电极的电极反应式:Mg-2e-═Mg2+ | |
| D. | 电池工作时,电子从石墨电极经导线流向Mg电极,溶液中阳离子流向正极 |
分析 该装置中Mg易失电子作负极,电极反应式为Mg-2e-=Mg2+,石墨电极是该电池的正极,H2O2具有氧化性,应在原电池的正极被还原,电极反应式为H2O2+2H++2e-═2H2O,据此分析解答.
解答 解:A.Mg易失电子发生氧化反应而作负极,石墨电极是该电池的正极,故A正确;
B.H2O2在石墨电极上得电子发生还原反应,故B正确;
C.Mg易失电子发生氧化反应而作负极,电极反应为:Mg-2e-=Mg2+,故C正确;
D.电池工作时,电子从负极Mg电极经导线流向石墨电极,溶液中阳离子流向正极,故D错误;
故选D.
点评 本题考查了原电池原理,由Mg、双氧水的性质确定正负极,会正确书写电极反应式,知道离子移动方向,题目难度不大.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率通过用单位时间里反应物浓度或生成物浓度的变化量表示 | |
| B. | 化学平衡状态指的是在一定条件下反应物和生成物浓度不再改变时的状态 | |
| C. | 决定化学反应速率的主要因素是温度 | |
| D. | 催化剂只能加快化学反应速率,不能提高原料利用率和转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的百分含量不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | v正(X)=2v逆(Y) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 水分子很稳定性是因为水分子间易形成氢键 | |
| C. | 二氧化碳电子式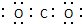 | |
| D. | 第三周期元素形成的简单离子中,半径最小的是Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com