
| 1 |
| 2 |
| m |
| M |
| 1 |
| 2 |
| 16g |
| 32g/mol |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,请回答下列问题:
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL0.1mol/L的NaCl溶液中,所含微粒总数为0.02NA |
| B、在标准状况下,11.2LSO3所含分子数为0.5NA |
| C、1molNa与足量O2反应生成Na2O或Na2O2均失去NA电子 |
| D、两份质量为5.6g的铁分别与足量的盐酸、氯气反应,电子转移总数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NO2与水反应:3NO2+H2O═2NO3-+NO+2H+ |
| B、Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ |
| C、将氯气溶于水制备次氯酸:Cl2+H2O═2H++Cl-+ClO- |
| D、将铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸和食醋既是化合物又是酸 |
| B、含氧酸酸性越强与铁片反应放出氢气的速率越快 |
| C、含4%硅的硅钢具有很好的导磁性,主要用作变压器铁芯 |
| D、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2溶液中加入少量氨水:Cu2++2OH-═Cu(OH)2↓ |
| B、向酸性KMnO4溶液中通入SO2:3SO2+2MnO4-+4OH-=2MnO2↓+3SO42-+2H2O |
| C、小苏打溶液中加足量澄清石灰水:HCO3?+Ca2++OH-═CaCO3↓+H2O |
| D、铝溶于氢氧化钠溶液:Al+2OH-+H2O=AlO2-+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.
现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题.| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道上电子全充满或半充满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
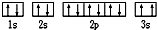 ,该同学所画的电子排布图违背了
,该同学所画的电子排布图违背了查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作与现象 | 实验结论 | 判断理由 | |
| 步骤一 | 加入过量NaOH溶液,得到蓝色沉淀; | 肯定有Cu2+、肯定无 | 肯定无该离子的理由 |
| 步骤二 | 将蓝色沉淀过滤、洗涤、灼烧得到24.0g固体; | Cu2+物质的量浓度为 | Cu元素守恒 |
| 步骤三 | 向上述滤液中加足量Ba(NO3)2溶液,得到46.6g不溶于稀硝酸的沉淀. | 肯定有Cl-、 | 肯定有Cl-的理由 |
查看答案和解析>>
科目:高中化学 来源: 题型:
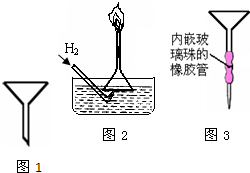 普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.
普通漏斗(见图1)是中学化学实验室常用仪器之一.我们对它的用途并不陌生.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com