
【题目】《中华人民共和国大气污染防治法》于2016年1月1日起实施。为保护和改善大气环境,下列做法不应该提倡的是( )
A. 开发生物质能源替代化石燃科 B. 向高空排放金属冶炼产生的粉尘
C. 用催化转化技术处理汽车尾气 D. 大力推广生产和便用无氟冰箱
 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
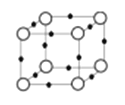
【题目】在周期表中1-36号之间的W、X、Y、Z、Q六种元素,它们的原子序数依次增大,已知W与其余五种元素既不同周期也不同主族,X原子的L层p轨道中有2个电子,Y元素原子的最外层有3个自旋方向相同的未成对电子,Z元素原子基态时,核外电子排布在3个能级上,且有2个未成对电子,Q元素在第四周期,原子的K层电子数与最外层电子数之比为2:1,其d轨道处于全充满状态。
(1)按电子排布,Q元素在周期表中属 区。
(2)第一电离能Y Z,电负性Y Z(填“>”“<”或“=”)。
(3)W与Z形成的常见化合物有W2Z、W2Z2,W与Y能形成多种二元化合物,如YW3、Y2W4、Y3W5、Y4W6……,W2Z分子中Z原子的杂化类型为 ,YW3分子的立体构型为 ,YW3极易溶于W2Z的主要原因有 。
(4)若向含有Q2+的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有深蓝色晶体析出,该晶体阳离子中含有的化学键有 。
(5)Q+与Y3-形成的晶胞结构如图所示。阴、阳离子间的核间距为a pm,阿伏伽德罗常数用NA表示,则晶体的密度为 g/cm3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的浓度的说法正确的是
A.将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液
B.500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol
C.把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L(忽略混合后体积变化)
D.把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组拟对一种焰火原料(由两种短周期的常见金属单质组成的合金粉末)进行探究。请完成下列探究报告。
【探究目的】探究该焰火原料的组成
【资料检索】①Mg2+检验方法:取2滴待检液,加入2滴2mol·L-1NaOH溶液,再加入1滴镁试剂(Ⅰ)染料(对硝基苯偶氮苯二酚)。若出现沉淀并吸附镁试剂(Ⅰ)染料呈天蓝色,表示待检液中含有Mg2+。Ag+、Cu2+、Fe3+、NH4+会妨碍Mg2+检出②Mg(OH)2可溶于浓的氯化铵溶液,其他的常见不溶碱难溶于氯化铵③很多合金是金属互化物,有确定的化学组成
【探究思路】①确定焰火原料所含金属种类;②测定焰火原料的化学式
【实验探究】
(1)甲同学进行了初步试验,实验步骤和实验现象如下。请填写下表。
试验序号 | 实验步骤 | 实验现象 | 结论 |
① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |
(2)乙同学取甲第②组实验的溶液,加入镁试剂(Ⅰ)染料,得出合金中不含镁。
乙的结论________________(选填“正确”或“错误”)。判断理由为。
(3)丙同学设计实验方案,确定焰火原料中的金属种类,实验记录如下。
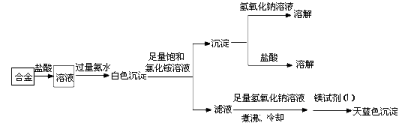
由丙的实验记录可知,该焰火原料是由_______和_________两种金属组成的合金;实验中滤液加入足量氢氧化钠溶液后需煮沸,煮沸的理由是______________________________。
(4)丁同学利用丙同学的结论,设计如下图所示的实验步骤,确定合金组成。
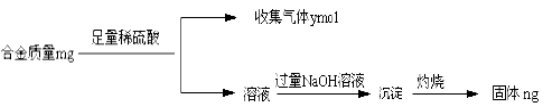
问题讨论:
①能确定合金组成的数据组有______________(填写选项字母);
A.m、n
B.m、y
C.n、y
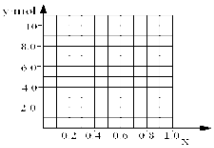
②若合金中相对原子质量较小的金属的物质的量分数为x,金属总物质的量为7mol,试在下图中作出y随x变化的曲线;
③当y=8.5mol时,该合金是一种金属互化物,其化学式为________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1mol/L的K2SO4溶液、0.2mol/L的Al2(SO4)3溶液和纯水混合,要使混合溶液中K+、Al3+、SO42-的浓度分别为0.1mol/L、0.1mol/L和0.2mol/L,则所取K2SO4溶液、Al2(SO4)3溶液、纯水三者体积比是(忽略混合后体积变化)
A.1:1:1 B.2:1:1 C.1:1:2 D.2:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
② CO(g)+2H2(g) ![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20mol CH4(g)和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。
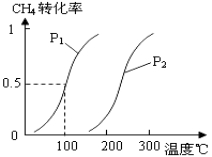
(1)温度不变,缩小体积,增大压强,①的反应速率 ______(填“增大”、“减小”或“不变”),平衡向 ___方向移动。
(2)温度升高,反应①的ΔH1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 ______。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3 a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
I | 150 | 1/3 | 0.1 |
II | 5 | ||
III | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液.在FeCl2液中需加入少量铁属,其目的是________。
(2)甲组同学取2mlFeCl2溶液.加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为__________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5ml煤油,再于液面下依次加入几滴氯水和l滴KSCN溶液,溶液变红,煤油的作用是____________。
(4)丙组同学取10 mL0.1mol/LKI溶液,加入6mL0.1mol/LFeCl3溶液混合。分别取2mL此溶液于3 支试管中进行如下实验:
① 第一支试管中加入1mLCCl4充分振荡、静置,CCl4层呈紫色;
② 第二只试管中加入1滴K3[Fe(CN)6] 溶液,生成蓝色沉淀:
③ 第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是________(填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有_________(填离子符号),由此可以证明该氧化还原反应为_________。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为___________;一段时间后,溶液中有大量气泡出现,随后有红褐色沉淀生成。产生气泡的原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是 ( )
A.乙烯可作水果的催熟剂
B.硅胶可作袋装食品的干燥剂
C.福尔马林可作食品的保鲜剂
D.氢氧化铝可作胃酸的中和剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com