
| ���Ӱ뾶 | �۵� | ���� |
| Cl- ��Na+ | NaCl ��C�����ʯ�� | H3PO4 ��HClO4 |
���� ��1��PԪ�ش��ڵ�������VA�壻
��2�����ӵ��Ӳ�Խ�࣬���Ӱ뾶Խ��һ��ԭ�Ӿ����۵�������Ӿ���ģ�Ԫ�طǽ�����Խǿ����ۺ����������Խǿ��
��3��CuCl��O2��Ӧ����CuCl2��һ�ֺ�ɫ���壬�ú�ɫ����ΪCuO��
��4��P������������Ӧ��ˮ����ΪH3PO4��Na������������Ӧ��ˮ����ΪNaOH�����߷�Ӧ���Եõ�Na3PO4��NaH2PO4��Na2HPO4��
��5����ҵ�Ͽ���Cl2ͨ��Na2CO3��Һ��ȡCl2O��ͬʱ����һ��ʳƷ�е����ɼ�����NaHCO3���ɣ�������NaCl��
��� �⣺��1��PԪ�ش��ڵ�������VA�壬Pԭ������������Ϊ5���ʴ�Ϊ��5��
��2�����ӵ��Ӳ�Խ�࣬���Ӱ뾶Խ�����Ӱ뾶��Cl-��Na+��NaCl�������Ӿ��壬���ʯ����ԭ�Ӿ��壬���۵�NaCl�����ʯ���ǽ�����P��Cl��Ԫ�طǽ�����Խǿ����ۺ����������Խǿ��������H3PO4��HClO4��
�ʴ�Ϊ��������������
��3��CuCl��O2��Ӧ����CuCl2��һ�ֺ�ɫ���壬�ú�ɫ����ΪCuO����Ӧ����ʽΪ��4CuCl+O2=2CuCl2+2CuO��
�ʴ�Ϊ��4CuCl+O2=2CuCl2+2CuO��
��4��P������������Ӧ��ˮ����ΪH3PO4��Na������������Ӧ��ˮ����ΪNaOH�����߷�Ӧ���Եõ�Na3PO4��NaH2PO4��Na2HPO4��
�ʴ�Ϊ��3��
��5����ҵ�Ͽ���Cl2ͨ��Na2CO3��Һ��ȡCl2O��ͬʱ����һ��ʳƷ�е����ɼ�����NaHCO3���ɣ�������NaCl����Ӧ���ӷ���ʽΪ��2Cl2+2CO32-+H2O=2HCO3-+2Cl-+Cl2O��
�ʴ�Ϊ��2Cl2+2CO32-+H2O=2HCO3-+2Cl-+Cl2O��
���� ���⿼��ṹ��λ�ù�ϵ�����뾶�Ƚϡ��������������ʡ�Ԫ�ػ��������ʡ���ѧ����ʽ��д�ȣ�����ƴ������Ŀ��ע��Ի���֪ʶ���������գ�


 ����5��2���ϵ�д�
����5��2���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ʵ�鷽�� | Ԥ������ | Ԥ������ |
| ����1����2 mL Na2CO3��Һ�еμ�1 mL 0.5 mol•L-1 CaCl2��Һ | �а�ɫ���� | Na2CO3��Һ�е�CO32-Ũ�Ƚϴ�����CaCl2������ӦCa2++CO32-=CaCO3����д���ӷ���ʽ�� |
| ����2����2 mL NaHCO3��Һ�еμ�1 mL 0.5 mol•L-1 CaCl2��Һ | �ް�ɫ���� | NaHCO3��Һ�е�CO32-Ũ�Ⱥ�С��������CaCl2��Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ÿĦ��������ϩ��������4 mol�巢���ӳɷ�Ӧ | |
| B�� | ������ʹ���Ը��������Һ��ɫ | |
| C�� | �������Ҵ�����������Ӧ | |
| D�� | ����ʳ����Ҫ�ɷ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
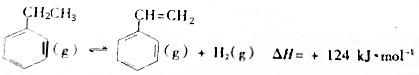
| ��ѧ�� | C-H | C-C | C=C | H-H |
| ����/kJ•mol��1 | 412 | 348 | x | 436 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ϡ����ɳ�ȥ��ƿ�ڲ�����MnO2 | B�� | ������ɫ��ڲ���ƿ���氱ˮ | ||
| C�� | ϡ����ɳ�ȥ�Թ��ڱ�ճ�е���� | D�� | �������ˮ�ɳ�ȥ���е�Ca��HCO3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ʵ�鷽������Ҫ��д����������̣� | Ԥ��ʵ�����ͽ��� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com