
| A | B | C | D | |
| 物质 | 硅  | 生石灰  | 液氨 | 亚硝酸钠 |
| 用途 | 半导体材料 | 抗氧化剂 | 制冷剂 | 食品防腐剂 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:填空题
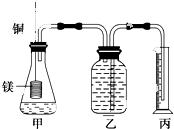 某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:
某研究性学习小组为证明在同温同压下,相同浓度相同体积的不同强度的二元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如图.该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 在4mL0.1mol•L-1的K2Cr2O7溶液中滴加数滴1mol•L-1的NaOH溶液,溶液颜色从橙色变成黄色 | |
| C. | 在用简易量热计测定反应热时,可使用碎泡沫起隔热保温的作用,迅速混合后测出初始温度,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应、准确读取实验时温度计最高温度、并且取2-3 次的实验平均值等措施,以达到良好的实验效果 | |
| D. | 将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶,过滤即可得到大量硝酸钾晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
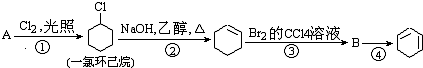
 ,名称是环己烷.
,名称是环己烷. +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$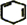 +2NaBr+2H2O.
+2NaBr+2H2O.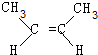 、
、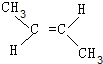 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaOH的质量分数 | 阳极析出物质的质量/g | 阴极析出物质的质量/g | |
| A | 6.2% | 19 | 152 |
| B | 6.2% | 152 | 19 |
| C | 4.2% | 1.2 | 9.4 |
| D | 4.2% | 9.4 | 1.2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖在人体内水解的最终产物是葡萄糖 | |
| B. | 蔬菜水果属于碱性食物,对人体健康有益 | |
| C. | 为了防止蛋白质发生盐析,疫苗等生物制剂要冷藏 | |
| D. | 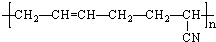 由CH2=CH2与CH2=CH-CN加聚而成 由CH2=CH2与CH2=CH-CN加聚而成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com