
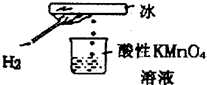
 某化学研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.判断下列说法中正确的是( )
某化学研究性学习小组在老师指导下做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色.若将烧杯中的溶液换成含有少量KSCN的FeCl2溶液,溶液显红色.判断下列说法中正确的是( )| A、该条件下生成的水分子化学性质比较活泼 |
| B、该条件下H2被冷却为液态氢,液氢的水溶液具有还原性 |
| C、该条件下H2燃烧生成了具有还原性的物质 |
| D、该条件下H2燃烧的产物中可能含有一定量的H2O2 |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
| A、一种纯净的化合物 |
| B、一种单质和一种化合物的混合物 |
| C、两种化合物的混合物 |
| D、两种单质的混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定无Na2CO3,可能有FeCl3 |
| B、可能有Na2CO3和NaCl |
| C、一定有MgCl2,可能有NaCl |
| D、一定有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
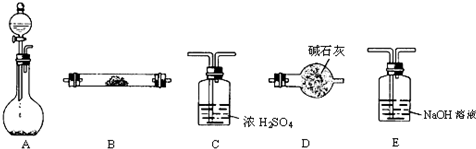
查看答案和解析>>
科目:高中化学 来源: 题型:
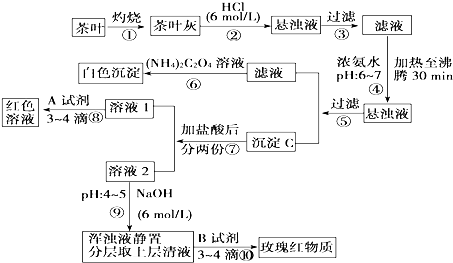
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )
,在某次合成反应中,用1.4g的2-甲基萘,才制得0.17g甲萘醌,已知该次合成反应的速率是快的,试判断导致其产率低的原因是( )| A、使用了过量的氧化剂 |
| B、没有用乙酸,而是使用了其它催化剂 |
| C、把反应混合物加热 |
| D、所生成的甲萘醌是沉淀物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
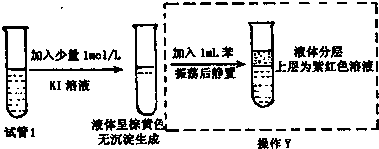
查看答案和解析>>
科目:高中化学 来源: 题型:
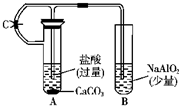 利用如图所示装置进行相关试验,验证铝的化合物的相关性质.请回答:
利用如图所示装置进行相关试验,验证铝的化合物的相关性质.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
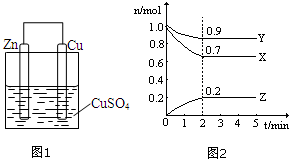 (1)设计的原电池如图1所示,回答下列问题:
(1)设计的原电池如图1所示,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com