
| A. | S(s)+O2(g)→SO2(g)+Q1kJ;S(g)+O2(g)→SO2(g)+Q2kJ | |
| B. | H2(g)+$\frac{1}{2}$O2(g)→H2O(l)+Q1kJ;H2(g)+$\frac{1}{2}$O2(g)→H2O(g)+Q2kJ | |
| C. | NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(l)+Q1kJ NaOH(aq)+HAc(aq)→NaAc(aq)+H2O(l)+Q2kJ | |
| D. | H2(g)+Cl2(g)→2HCl(g)+Q1kJ,H2(g)+I2(g)→2HI(g)+Q2kJ |
分析 A、当产物相同时,反应物的能量越高,反应放出的热量越多;
B、当反应物相同时,产物的能量越低,反应放出的热量越高;
C、弱电解质的电离要吸热;
D、物质越活泼,键能越小,断键时吸收的能量越少.
解答 解:A、1molS(g)的能量大于1molS(s)的能量,而当产物相同时,反应物的能量越高,反应放出的热量越多,故Q1<Q2,故A错误;
B、1molH2O(g)的能量高于1molH2O(l)的能量,当反应物相同时,产物的能量越低,反应放出的热量越高,故Q1>Q2,故B正确;
C、醋酸是弱电解质,HCl是强电解质,而弱电解质的电离要吸热,导致第二个反应放出的热量偏小,故Q1>Q2,故C正确;
D、因为Cl2比Br2活泼,Cl-Cl键能较小,断键时吸收的较少,则放出的热量更多,故Q1>Q2,故D正确.
故选BCD.
点评 本题考查了反应放出热量的大小比较,应注意的是对于放热反应,当反应物相同时,产物的能量越低,反应放出的热量越高,当产物相同时,反应物的能量越高,反应放出的热量越多.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题

| A. | 由图象Ⅰ可知,该反应在T1、T3处达到平衡 | |
| B. | 由图象Ⅰ可知,该反应的△H>0 | |
| C. | 图象Ⅱ发生反应的化学方程式为2X+6Y?3Z | |
| D. | 由图象Ⅱ可知,相同条件下起始时投入0.1mol•L-1 Y、0.3mol•L-1 Z和0.4mol•L-1 Z反应,达到平衡后,Z的浓度为0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氢氧燃料电池的正极反应:H2-2e-+2OH-═2H2O | |
| B. | 用电子式表示NaCl的形成过程: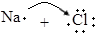 →Na+[ →Na+[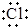 ]- ]- | |
| C. | 少量二氧化硫通入次氯酸钠碱性溶液中:SO2+C1O一+2OH-═SO42-+Cl-+H2O | |
| D. | 汽车尾气系统的催化转化器可降低NO等的排放:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
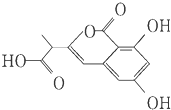
| A. | 该有机物中含一个手性碳原子 | |
| B. | 1 mol该有机物最多可以和3 mol NaOH反应 | |
| C. | 该有机物能发生水解反应 | |
| D. | 该有机物容易发生加成、取代、消去等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇、乙酸都可以与钠反应生成氢气 | |
| B. | 油脂、淀粉、纤维素都属于天然高分子化合物 | |
| C. | 甲苯和乙烯都可与溴水发生化学反应造成溴水褪色 | |
| D. | 蛋白质溶液加入CuSO4溶液会析出,这一过程属于蛋白质的盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
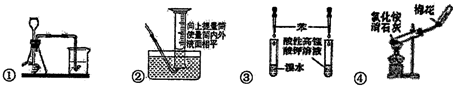
| A. | ①检查装置气密性 | B. | ②读取气体体积 | ||
| C. | ③验证苯中是否有碳碳双键 | D. | ④实验室制取并收集氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com