
已知A、B为单质,C为化合物。
能实现上述转化关系的是
①若C溶于水后得到强碱溶液,则A可能是Na
②若C的溶液遇Na2CO3放出CO2气体,则A可能是H2
③若C的溶液中滴加KSCN溶液显红色,则B可能为Fe
④若C的溶液中滴加NaOH溶液有蓝色沉淀生成,则B可能为Cu
A.①② B.②④ C.①③ D.③④
B
【解析】
试题分析:①若A是Na,Na在氧气中燃烧生成过氧化钠,过氧化钠溶于水生成强碱NaOH,电解NaOH溶液相当于电解水,生成氢气和氧气,错误;②若A是H2,氢气在氯气中燃烧生成HCl,盐酸遇Na2CO3 放出CO2 ,电解盐酸生成氢气和氯气,正确;③若B为Fe,Fe在氯气中燃烧生成FeCl3 ,FeCl3 的溶液中滴加KSCN溶液显红色,电解FeCl3 溶液生成氯化亚铁和氯气,错误;④若B为Cu,Cu在氯气中燃烧生成CuCl2 ,CuCl2 的溶液中滴加NaOH溶液有蓝色沉淀生成,电解CuCl2 溶液生成Cu和氯气,正确;选B。
考点:考查常见物质的相互转化。
考点分析: 考点1:电解池 考点2:无机框图推断 试题属性

科目:高中化学 来源:2014-2015上海市高一上学期期末考试化学试卷(解析版) 题型:选择题
关于某温度时的饱和溶液的说法中,正确的是
A.已溶解的溶质和未溶解的溶质质量相等
B.溶质不再溶解,因此从表面看溶质不再减少,也不再增加
C.升高温度,饱和溶液将变为不饱和溶液
D.溶质的溶解和结晶继续进行,且速率相等
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三第二次模拟理综化学试卷(解析版) 题型:选择题
下列有关实验的叙述正确的是
A.滴定实验时,锥形瓶用蒸馏水洗净后,直接盛待测液
B.用100 mL量筒配制100 mL 0.1000 mol·L-1 Na2CO3溶液
C.用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色,则原溶液含有钠盐
D.某溶液加入盐酸酸化的BaCl2溶液,如果有白色沉淀生成,则原溶液含有SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考试理综化学试卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。

下列有关说法正确的是
A.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.步骤④的作用是达到富集溴的目的
C.过程②中MgCl2·6H2O加热脱水制得无水MgCl2
D.工业上电解熔融精盐的过程称为氯碱工业
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:实验题
(16分)利用明矾石(主要成分:K2SO4·Al2(SO4)3·2Al2O3·6H2O,少量杂质Fe2O3)制备氢氧化铝的流程如下图所示:
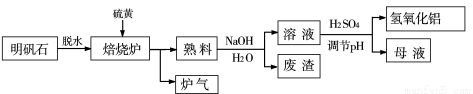
(1)焙烧炉中反应为:2Al2(SO4)3+3S=2Al2O3+9SO2;该反应的氧化剂及被氧化的元素分别是: ;若生成1 mol Al2O3,则转移电子数是 个;
(2)熟料溶解时的离子方程式: 。
(3)检验废渣中含有Fe2O3所需的试剂: 。所观察到的现象为 。
(4)母液中溶质的主要成分的化学式为: ;溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀洗涤干净的实验操作和现象是: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.滴入酚酞呈无色的溶液中:K+、Al3+、Cl-、CO32 -
B.澄清的溶液中:Na+、K+、MnO4—、AlO2—
C. =10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
=10-13 mol·L-1的溶液:Na+、[Ag(NH3)2]+、OH-、NO3-
D.c(I-)=0.1 mol·L-1的溶液中:Na+、H+、ClO-、SO42 -
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广西玉林市博白县高三下学期返校调研考试化学试卷(解析版) 题型:选择题
化学与生活息息相关.下列说法不正确的是
A.可用淀粉﹣KI试纸和食醋检验真假碘盐
B.用饱和氯化铵溶液可以清洗金属表面的锈迹
C.次氯酸钠溶液是生活中常用的消毒剂
D.经常食用含明矾的食品能中和过多的胃酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省汕头市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
氢氧燃料电池以氢气作还原剂,氧气作氧化剂,电极为多孔镍,电解质溶液为30%的氢氧化钾溶液。下列说法正确的是:
A.负极反应为:2H2+4OH- - 4e- = 4H2O
B.负极反应为:O2+2H2O+4e-= 4OH-
C.电池工作时溶液中的阴离子移向正极移动
D.电池工作时正极区pH升高,负极区pH下降
查看答案和解析>>
科目:高中化学 来源:2015年期中备考总动员高三化学模拟卷【福建】3(解析版) 题型:实验题
(14分)某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ.制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是 (用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ.实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;
②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;
④增加尾气吸收装置。
改进装置如图(夹持和加热装置略去)。
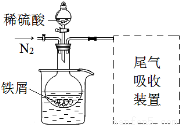
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
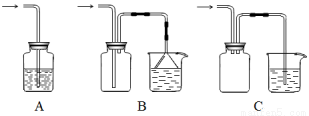
(5)下列装置适合尾气吸收的是 (填序号)。
Ⅲ.晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000g置于锥形瓶中,加入10mL3molL-1硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000 mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com