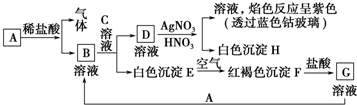
分析:(1)根据MnO
2和浓盐酸反应制Cl
2的化学方程式MnO
2+4HCl(浓)
MnCl
2+2H
2O+Cl
2↑结合离子方程式的书写方法解答;
(2)反应MnO
2+4HCl(浓)
MnCl
2+2H
2O+Cl
2↑中,Cl元素化合价升高,被氧化,HCl为还原剂,盐酸同时起到酸性的作用,Mn元素化合价降低,被还原,MnO
2为氧化剂,当有4mol HCl被氧化时,可生成2mol氯气,Cl元素化合价由-1价升高到0价,则转移电子数为4N
A;
(3)由方程式可知,4molHCl参加反应,生成1molCl
2,被氧化的Cl
-的物质的量2mol,当有0.4molHCl被氧化时,生成氯气0.2mol;
(4)根据2Cl
2+2Ca(OH)
2=CaCl
2+Ca(ClO)
2+2H
2O以及漂白粉的主要成分是CaCl
2与Ca(ClO)
2解答.
解答:
解:(1)实验室是用二氧化锰和浓盐酸反应制氯气发生反应的化学方程式是MnO
2+4HCl
MnCl
2+Cl
2↑+2H
2O,二氧化锰难溶于水写化学式,水是弱电解质写化学式,所以其离子方程式为MnO
2+4H
++2Cl
- Mn
2++Cl
2↑+2H
2O,
故答案为:MnO
2+4H
++2Cl
- Mn
2++Cl
2↑+2H
2O;
(2)在4HCl(浓)+MnO
2Cl
2↑+MnCl
2+2H
2O中,Mn元素的化合价降低,Cl元素得化合价升高,则MnO
2为氧化剂,HCl为还原剂,由方程式可知,盐酸在反应中起到酸性和还原剂的作用,4molHCl参加反应,生成1molCl
2,Cl元素化合价由-1价升高到0价,由Cl
2~2Cl
- 可知,被氧化的Cl
-的物质的量1mol×2=2mol,转移电子数为2N
A,则当有0.4mol HCl被氧化时,可生成0.2mol氯气,则转移电子数为0.4N
A,
故答案为:0.4;
(3)在4HCl(浓)+MnO
2Cl
2↑+MnCl
2+2H
2O中,4molHCl参加反应,生成1molCl
2,被氧化的Cl
-的物质的量1mol×2=2mol,当有0.4molHCl被氧化时,生成氯气0.2mol,标准状况下得体积为0.2mol×22.4L/mol=4.48L,
答:生成Cl
2的体积是4.48L;
(4)当有0.4mol HCl被氧化时,可生成0.2mol氯气,2Cl
2+2Ca(OH)
2=CaCl
2+Ca(ClO)
2+2H
2O
2mol 111g 143g
0.2mol 11.1g 14.3g
漂白粉的主要成分是CaCl
2与Ca(ClO)
2则所得漂白粉的质量为11.1g+14.3g=25.4g,
答:可制得漂白粉为25.4g;



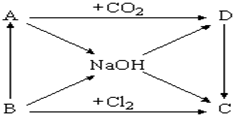 如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.
如图表示A~D及NaOH等物质间的相互转化关系,其中A为淡黄色固体,B为短周期元素中金属性最强的单质.
 B.
B.