
 ,这种炔烃的名称为( )
,这种炔烃的名称为( )| A. | 5-甲基-3-乙基-1-己炔 | B. | 5-甲基-3-乙基-2-己炔 | ||
| C. | 4-甲基-5-乙基-2-己炔 | D. | 2-甲基-4-乙基-5-己炔 |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.根据加成原理采取逆推法还原C≡C三键,烷烃分子中相邻碳原子上均带2个氢原子的碳原子间是对应炔存在C≡C的位置,含有一个三键的炔烃、加氢后的产物结构简式为: ,这种炔烃中含有的碳碳三键需要满足碳原子形成四个化学键的结构需求,所以只能位于CH3-CH2-这两个碳原子间,炔的结构简式为:
,这种炔烃中含有的碳碳三键需要满足碳原子形成四个化学键的结构需求,所以只能位于CH3-CH2-这两个碳原子间,炔的结构简式为: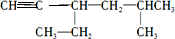 ,选取含碳碳三键在内的最长碳链为主碳链,离碳碳三键近的一端给主碳链编号确定名称.
,选取含碳碳三键在内的最长碳链为主碳链,离碳碳三键近的一端给主碳链编号确定名称.
解答 解:含有一个三键的炔烃、加氢后的产物结构简式为 ,这种炔烃中含有的碳碳三键需要满足碳原子形成四个化学键的结构需求,所以只能位于CH3-CH2-这两个碳原子间,炔的结构简式为
,这种炔烃中含有的碳碳三键需要满足碳原子形成四个化学键的结构需求,所以只能位于CH3-CH2-这两个碳原子间,炔的结构简式为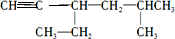 ,选取含碳碳三键在内的最长碳链为主碳链,离碳碳三键近的一端给主碳链编号确定名称为:5-甲基-3-乙基-1-己炔,故选A.
,选取含碳碳三键在内的最长碳链为主碳链,离碳碳三键近的一端给主碳链编号确定名称为:5-甲基-3-乙基-1-己炔,故选A.
点评 本题考查了加成反应、有机物结构特征、系统命名法的应用等知识点,注意碳原子形成四个共价键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 0.2(b-2a)mol•L-1 | B. | 20(b-2a)mol•L-1 | C. | 20 (b-a) mol•L-1 | D. | 20(2a-b) mol•L-1 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:实验题
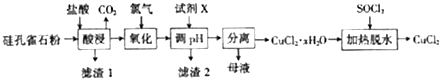
过碳酸钠(2Na2CO3•3H2O2)是由Na2CO3与H2O2复合而形成的一种固体放氧剂,同时具有Na2CO3和H2O2双重性质。可用于洗涤、纺织、医药、卫生等领域.工业上常以过碳酸钠产品中活性氧含量([O]%= 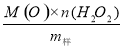 ×100来衡量其优劣,13%以
×100来衡量其优劣,13%以 上为优等品。一种制备过碳酸钠的工艺流程如图:
上为优等品。一种制备过碳酸钠的工艺流程如图:
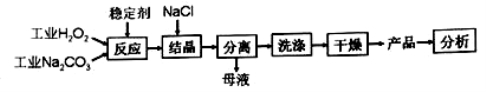
回答下列问 题:
题:
(1)过碳酸钠受热易分解,写出反应的化学方程式_____________________.
(2)稳定剂及反应温度等因素对产品质量有很大影响.
①下列试剂中,可能用作“稳定剂”的是__________(填字母).
a.MnO2 b.KI c .Na2SiO3 d.FeCl3
.Na2SiO3 d.FeCl3
②反应温度对产品产率(y%)及活性氧含量的影响如下图所示.要使产品达到优等品且产率超过90%合适的反应温度范围是_______________.
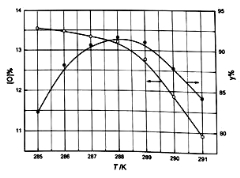
③“结晶”时加入NaCl的目的是____________ .
(3)“母液”中可循环利用的主要物质是_________________ ___.
___.
(4)产品中活性氧含量的测定方法:称量0.1600g样品,在250mL锥形瓶中用100mL 0.5mol•L-1硫酸溶解完全,立即用0.02000mol•L-1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMn04溶液的平均体积为2.24mL.
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有_______________.
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响 (填“偏大”、“偏小”或“不变”)及其原因____________.
③该样品的活性氧含量为__________% 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第二次月考化学试卷(解析版) 题型:选择题
室温时,在容积为amL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入bmLO2,则管内液面又继续上升,测得试管内最后剩余气体为cmL,且该气体不能支持燃烧。则a、b、c的关系是
A.a=4b+3c B.a=4b+c C.a:b=4:1 D.a:b=4:3
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
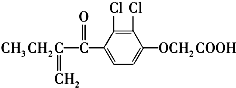 利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:
利尿酸是奥运会上被禁用的兴奋剂之一,其结构简式如下:| A. | 利尿酸分子内处于同一平面的原子数不超过10个 | |
| B. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14Cl2O4 | |
| C. | 该有机物有4种官能团 | |
| D. | 利尿酸能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 | |
| B. | 正戊烷分子中所有原子均在一条直线上 | |
| C. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定符合通式CnH2n+2 | |
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 CCH3CH2OHD
CCH3CH2OHD ECH3COOH
ECH3COOH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com