
·ÖĪö £Ø1£©ÉčŌÓŠO2 ĪŖ1 mol£¬¼ĘĖć×Ŗ»ÆµÄŃõĘųÓėÉś³ÉµÄ³ōŃõµÄĪļÖŹµÄĮ棬½ų¶ų¼ĘĖćŹ£ÓąµÄŃõĘųµÄĪļÖŹµÄĮ棬øł¾ŻĘ½¾łÄ¦¶ūÖŹĮæ¼ĘĖć£»
£Ø2£©øł¾Ż²īĮæ·Ø¼ĘĖć³ōŃõµÄĢå»ż£»
£Ø3£©øł¾Żn=$\frac{V}{{V}_{m}}$»ģŗĻĘųĢåµÄĪļÖŹµÄĮ棬Ķ·ŪŌö¼ÓµÄÖŹĮæĪŖOŌ×ÓµÄÖŹĮ棬øł¾ŻŌ×ÓŹŲŗć¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©ÉčŌÓŠO2 1 mol£¬·¢Éś·“Ó¦µÄO2ĪŖ1 mol”Į50%=0.5 mol£®
ÓÉ·“Ó¦3O2$\frac{\underline{\;·Åµē\;}}{\;}$2O3ÖŖ£ŗÉś³ÉµÄO3ĪŖ0.5mol”Į$\frac{2}{3}$£¬¹Ź·“Ó¦ŗóĖłµĆĘųĢåĪŖ$\frac{1}{3}$ mol O3ŗĶO2ĪŖ£Ø1-0.5£©mol=0.5 mol£¬
¹Ź$\overline{M}$=$\frac{0.5mol”Į32g/mol+\frac{1}{3}mol”Į48g/mol}{0.5mol+\frac{1}{3}mol}$=38.4 g/mol£¬Ōņ»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæĪŖ38.4£»
¹Ź“š°øĪŖ£ŗ38.4£»
£Ø2£©3O2$\frac{\underline{\;·Åµē\;}}{\;}$2O3 ”÷V
2 1
V£ØO3£© £Ø10-7.8£©L
ĖłŅŌV£ØO3£©=2”Į£Ø10-7.8£©L=4.4L£¬
¹Ź“š°øĪŖ£ŗ4.4£»
£Ø3£©n£Ø»ģŗĻĘųĢ壩=$\frac{0.896}{22.4}$=0.04mol£»
Éč³ōŃõµÄĢå»ż·ÖŹżĪŖa£¬øł¾ŻŃõŌ×ÓŹŲŗć
0.04mol”Įa”Į3+0.04mol”Į£Ø1-a£©”Į2=$\frac{21.6-20}{16}$mol
½āµĆa=0.5
“š£ŗŌ»ģŗĻĘųĢåÖŠO3µÄĢå»ż·ÖŹżĪŖ0.5£®
µćĘĄ ±¾Ģāæ¼²éѧɜøł¾Ż·½³ĢŹ½µÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬×¢Ņā£Ø2£©ÖŠĄūÓĆ²īĮæ·Ø½ųŠŠ¼ĘĖć£¬æÉŅŌ¼ņ»Æ¼ĘĖć£¬½Ļ³£¹ę·½·ØĢÖĀŪ¼ņµ„£¬²ąÖŲÓŚæ¼²éѧɜµÄ·ÖĪöÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŌŚ·“Ó¦¢ŁŗĶ¢ŚÖŠ£¬ĀČ»ÆÄĘ¾ł¼ČŹĒŃõ»Æ¼Į£¬ÓÖŹĒ»¹Ō¼Į | |
| B£® | ŌŚ·“Ó¦¢ŁÖŠĀČĘųŹĒ»¹Ō²śĪļ£¬ŌŚ·“Ó¦¢ŚÖŠĒāĘųŹĒ»¹Ō²śĪļ | |
| C£® | Čō±ź×¼×“æöĻĀÉś³ÉµČĢå»żµÄĘųĢ壬Ōņ·“Ó¦¢ŁŗĶ¢ŚÖŠ×ŖŅʵē×Ó×ÜŹżĻąµČ | |
| D£® | ČōĻūŗĵČÖŹĮæµÄĀČ»ÆÄĘ£¬Ōņ·“Ó¦¢ŁŗĶ¢ŚÖŠ×ŖŅʵē×Ó×ÜŹżĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | øĆĮņĖįµÄĪļÖŹµÄĮæÅضČĪŖ9.2mol/L | |
| B£® | ÅäÖĘ500mL 4.6mol/LµÄĻ”ĮņĖįŠčČ”øĆĮņĖį125mL | |
| C£® | 1mol CuÓė×ćĮæµÄøĆĮņĖį·“Ó¦²śÉś2gĒāĘų | |
| D£® | µČÖŹĮæµÄĖ®ÓėøĆĮņĖį»ģŗĻĖłµĆČÜŅŗµÄĪļÖŹµÄĮæÅØ¶Č“óÓŚ9.2mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
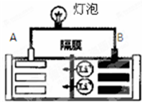 ³£¼ūµÄŅ»ÖÖļ®Ąė×Óµē³ŲµÄ¹¤×÷ŌĄķĪŖLiCoO2+6C$?_{·Åµē}^{³äµē}$Li1-xCoO2+LixC6£®µē³Ų¹¤×÷Ź±ČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©
³£¼ūµÄŅ»ÖÖļ®Ąė×Óµē³ŲµÄ¹¤×÷ŌĄķĪŖLiCoO2+6C$?_{·Åµē}^{³äµē}$Li1-xCoO2+LixC6£®µē³Ų¹¤×÷Ź±ČēĶ¼ĖłŹ¾£®ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø””””£©| A£® | øƵē³Ų·ÅµēŹ±AĪŖøŗ¼« | |
| B£® | øƵē³Ų·ÅµēŹ±Õż¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗLi1-xCoO2+xLi+xe?ØTLiCoO2 | |
| C£® | øƵē³Ų³äµēŹ±Ńō¼«ÖŹĮæ¼õĒį | |
| D£® | øƵē³Ų³äµēŹ±Ņõ¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗ6C+xLi++xe-ØTLixC6 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | HCO3-+H2O?H2CO3+OH- | B£® | Al3++3H2O?Al£ØOH£©3+3H+ | ||
| C£® | 2Al3++3CO32-?Al2£ØCO3£©3 | D£® | Br-+H2O?HBr+OH- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
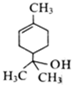
| A£® | ŻĘĘ·“¼µÄ·Ö×ÓŹ½ĪŖC9H10O | |
| B£® | ŻĘĘ·“¼ÄÜ·¢Éś¼Ó³É·“Ó¦ŗĶČ”“ś·“Ó¦ | |
| C£® | ŻĘĘ·“¼Äܱ»øßĆĢĖį¼Ų±»ŗĶäåĖ®Ńõ»Æ | |
| D£® | 1molŻĘĘ·“¼×ī¶ąÓė3mol H2·¢Éś·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ClCH2CHØTCH2+NaOH$”ś_{”÷}^{H_{2}O}$HOCH2CHØTCH2+NaCl | |
| B£® | CH2ØTCHCH3+Cl2”śCH2ClCHClCH3 | |
| C£® | 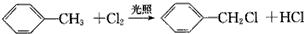 | |
| D£® |  |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com