
| A. | ②④ | B. | ①③⑤ | C. | ②③④ | D. | ①⑤ |
分析 ①活泼性较弱的金属,可通过加热其氧化物获得金属单质,如金属汞;
②钠在溶液中无法置换出铜;
③氯化铝为共价化合物,熔融状态不导电;
④电解饱和食盐水生成氢氧化钠、氢气和氯气,无法获得金属钠;
⑤Mg的活泼性大于铝,所以不能利用铝热反应制取镁.
解答 解:①金属汞的化学性质不活泼,可用加热HgO分解的方法制取Hg,故①正确;
②将钠加入氯化铜溶液中,钠先与水反应生成氢氧化钠和氢气,生成的氢氧化钠再与氯化铜溶液反应,无法获得金属铜,故②错误;
③氯化铝属于共价化合物,无法通过电解熔融氯化铝制取铝,通常采用电解熔融氧化铝获得金属铝,故③错误;
④电解饱和食盐水得到的是NaOH、氢气和氯气,无法获得金属钠,通常用电解熔融氯化钠获得钠,故④错误;
⑤铝热反应中置换出的金属活泼性必须小于铝,所以不能利用铝热反应制取镁,故⑤正确;
故选C.
点评 本题考查了常见金属的性质及冶炼方法,题目难度中等,明确常见金属的冶炼方法为解答关键,注意掌握常见金属及其化合物性质,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
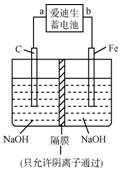 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 据悉中国在建的第二艘航母中使用了素有“现代工业的骨骼”之称的碳纤维,碳纤维是一种新型的有机高分子材料 | |
| B. | 离子交换膜在工业上应用广泛,如氯碱工业使用阴离子交换膜 | |
| C. | 获得2015年诺贝尔生理学、医学奖屠呦呦女士用乙醚从黄花蒿中提取出青蒿素,该技术应用了萃取原理 | |
| D. | 酸碱指示剂变色、煤的液化、蛋白质的颜色反应、海水提取溴、焰色反应都涉及化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥2b时,发生的离子反应为:2OH-+CO2═CO32-+H2O | |
| B. | 当a=1.25b时,发生的离子方程式为:5OH-+4CO2═3HCO3-+CO32-+H2O | |
| C. | $\frac{2b}{3}$<a<2b时,溶液中CO32-与HCO3-物质的量之比为:(2b-a):(2a-b) | |
| D. | 若反应后溶液中CO32-与OH-物质的量之比为2:1,则5b=a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水制氯气时,用铜片作阳极 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 在原电池中,电子流出的一极是负极,发生氧化反应 | |
| D. | 在铁制品上镀银时,铁制品与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极:Cd-2e-═Cd2+ | |
| B. | 放电时正极:2NiOOH+2e-+2H2O═2Ni(OH)2+2OH- | |
| C. | 充电时阳极:2Ni(OH)2-2e-+4H+═2Ni3++4H2O | |
| D. | 充电时含Cd的电极应与电源的正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com