
 pC(g)£¬“ļµ½Ę½ŗāŗ󣬵±ÉżøßĪĀ¶ČŹ±£¬BµÄ×Ŗ»ÆĀŹ±ä“ó£»µ±¼õŠ”Ń¹ĒæŹ±£¬»ģŗĻĢåĻµÖŠCµÄÖŹĮæ·ÖŹż¼õŠ”£¬Ōņ£ŗ
pC(g)£¬“ļµ½Ę½ŗāŗ󣬵±ÉżøßĪĀ¶ČŹ±£¬BµÄ×Ŗ»ÆĀŹ±ä“ó£»µ±¼õŠ”Ń¹ĒæŹ±£¬»ģŗĻĢåĻµÖŠCµÄÖŹĮæ·ÖŹż¼õŠ”£¬Ōņ£ŗ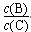 ½«________”£
½«________”£ 2NH3(g)””¦¤H<0”£·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
2NH3(g)””¦¤H<0”£·“Ó¦ÖŠNH3µÄĪļÖŹµÄĮæÅØ¶ČµÄ±ä»ÆĒéæöČēĶ¼ĖłŹ¾£¬Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ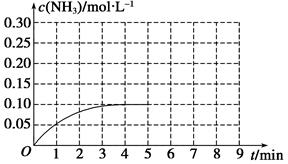
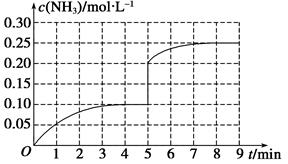
 pC(g)£¬“ļµ½Ę½ŗāŗ󣬵±ÉżøßĪĀ¶ČŹ±£¬BµÄ×Ŗ»ÆĀŹ±ä“ó£¬ĖµĆ÷ÕżĻņŅĘ¶Æ£¬ĪŖĪüČČ·“Ó¦£»µ±¼õŠ”Ń¹ĒæŹ±£¬»ģŗĻĢåĻµÖŠCµÄÖŹĮæ·ÖŹż¼õŠ”£¬ŌņĘ½ŗā×óŅĘ£¬Õż·“Ó¦µÄĘųĢåĻµŹż¼õŠ””£Ōņ£ŗ
pC(g)£¬“ļµ½Ę½ŗāŗ󣬵±ÉżøßĪĀ¶ČŹ±£¬BµÄ×Ŗ»ÆĀŹ±ä“ó£¬ĖµĆ÷ÕżĻņŅĘ¶Æ£¬ĪŖĪüČČ·“Ó¦£»µ±¼õŠ”Ń¹ĒæŹ±£¬»ģŗĻĢåĻµÖŠCµÄÖŹĮæ·ÖŹż¼õŠ”£¬ŌņĘ½ŗā×óŅĘ£¬Õż·“Ó¦µÄĘųĢåĻµŹż¼õŠ””£Ōņ£ŗ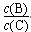 ½«¼õŠ””£
½«¼õŠ””£ 2NH3(g)
2NH3(g) 2NH3(g)
2NH3(g)

 ĢģĢģĮ·æŚĖćĻµĮŠ“š°ø
ĢģĢģĮ·æŚĖćĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2C(g)ŌŚ¹Ģ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ”£ČōĻņČŻĘ÷ÖŠ³äČė1molAŗĶ1molB£¬ŌŚT”ę“ļĘ½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖm%£»ČōĻņČŻĘ÷ÖŠ³äČė2molC£¬T”ę“ļĘ½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖn%£»ČōĻņČŻĘ÷ÖŠ³äČė1molC£¬T”ę“ļĘ½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖp%”£Ōņm”¢n”¢pµÄ¹ŲĻµŹĒ ””””””””
2C(g)ŌŚ¹Ģ¶ØČŻ»żµÄĆܱÕČŻĘ÷ÖŠ½ųŠŠ”£ČōĻņČŻĘ÷ÖŠ³äČė1molAŗĶ1molB£¬ŌŚT”ę“ļĘ½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖm%£»ČōĻņČŻĘ÷ÖŠ³äČė2molC£¬T”ę“ļĘ½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖn%£»ČōĻņČŻĘ÷ÖŠ³äČė1molC£¬T”ę“ļĘ½ŗāŹ±£¬CµÄĢå»ż·ÖŹżĪŖp%”£Ōņm”¢n”¢pµÄ¹ŲĻµŹĒ ””””””””| A£®m =" n" = p | B£®n > p >m | C£®m =" n" > p | D£®n > m >p |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 CH3CH2OH(g)+H2O(g) ”÷H£½”Ŗ255.6 kJ”¤mol”Ŗ1£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
CH3CH2OH(g)+H2O(g) ”÷H£½”Ŗ255.6 kJ”¤mol”Ŗ1£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ| A£®·“Ó¦ĪļµÄ×ÜÄÜĮæ“óÓŚÉś³ÉĪļµÄ×ÜÄÜĮæ |
| B£®Ōö“óH2ÅضČæÉŅŌŹ¹CO×Ŗ»ÆĀŹ“ļµ½100ØG |
| C£®Ź¹ÓĆŗĻŹŹµÄ“߻ƼĮ”¢ÉżøßĪĀ¶Č¾łæɼӓó·“Ó¦ĖŁĀŹ |
| D£®·“Ó¦“ļµ½Ę½ŗāŹ±£¬Õż·“Ó¦ŗĶÄę·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹĻąµČĒŅ²»ĪŖĮć |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 7N2£«12 H2OæÉ“¦ĄķNO2”£µ±×ŖŅĘ1.2molµē×ÓŹ±£¬ĻūŗĵÄNO2ŌŚ±ź×¼×“æöĻĀŹĒ L”£
7N2£«12 H2OæÉ“¦ĄķNO2”£µ±×ŖŅĘ1.2molµē×ÓŹ±£¬ĻūŗĵÄNO2ŌŚ±ź×¼×“æöĻĀŹĒ L”£ 2SO3£Øg£© ¦¤H= ”Ŗ196.6 kJ”¤mol-1
2SO3£Øg£© ¦¤H= ”Ŗ196.6 kJ”¤mol-1 2NO2£Øg£© ¦¤H= ”Ŗ113.0 kJ”¤mol-1
2NO2£Øg£© ¦¤H= ”Ŗ113.0 kJ”¤mol-1 SO3£Øg£©+NO£Øg£©µÄ¦¤H= kJ”¤mol-1”£
SO3£Øg£©+NO£Øg£©µÄ¦¤H= kJ”¤mol-1”£²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2NH3ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ
2NH3ŅŃ“ļµ½Ę½ŗāדĢ¬µÄŹĒ| A£®3v(H2) = 2v(NH3) | B£®3vÕż(H2) = 2vÄę(NH3) |
| C£®3v(N2) = v(H2) | D£®2vÕż(N2) = vÄę(NH3) |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗŹµŃéĢā
 xC(g)£«yD(g)£¬“ļµ½Ę½ŗāŹ±CµÄĢå»ż·ÖŹżĪŖm%£¬ČōĪ¬³ÖĪĀ¶Č”¢Ń¹Ēæ²»±ä£¬½«0.6 L A”¢0.4 L B”¢4 L C”¢0.8 L D×÷ĪŖĘšŹ¼ĪļÖŹ³äČėĆܱÕČŻĘ÷ÄŚ£¬“ļµ½Ę½ŗāŹ±CµÄĢå»ż·ÖŹżČŌĪŖm%£¬Ōņx£½________£¬y£½________.
xC(g)£«yD(g)£¬“ļµ½Ę½ŗāŹ±CµÄĢå»ż·ÖŹżĪŖm%£¬ČōĪ¬³ÖĪĀ¶Č”¢Ń¹Ēæ²»±ä£¬½«0.6 L A”¢0.4 L B”¢4 L C”¢0.8 L D×÷ĪŖĘšŹ¼ĪļÖŹ³äČėĆܱÕČŻĘ÷ÄŚ£¬“ļµ½Ę½ŗāŹ±CµÄĢå»ż·ÖŹżČŌĪŖm%£¬Ōņx£½________£¬y£½________.²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 2HNO3£«NO ¦¤H<0£¬ĪŖĢįøßNO2µÄ×Ŗ»ÆĀŹ£¬ĄķĀŪÉĻÓ¦øĆ²ÉČ”µÄ“ėŹ©ŹĒ£Ø £©
2HNO3£«NO ¦¤H<0£¬ĪŖĢįøßNO2µÄ×Ŗ»ÆĀŹ£¬ĄķĀŪÉĻÓ¦øĆ²ÉČ”µÄ“ėŹ©ŹĒ£Ø £©| A£®¼õŃ¹”””””””””””” | B£®ÉżĪĀ | C£®ŌöŃ¹ | D£®¼Ó“߻ƼĮ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā

 CO(g)£«3H2(g) ”÷H£¾0”£
CO(g)£«3H2(g) ”÷H£¾0”£ CH3OH(g)£¬COµÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾£¬Ōņ£ŗ
CH3OH(g)£¬COµÄĘ½ŗā×Ŗ»ÆĀŹÓėĪĀ¶Č”¢Ń¹ĒæµÄ¹ŲĻµČēÓŅĶ¼ĖłŹ¾£¬Ōņ£ŗ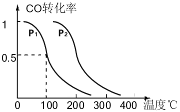
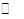 CH3OH(g)µÄĘ½ŗā³£ŹżKµÄÖµĪŖ
CH3OH(g)µÄĘ½ŗā³£ŹżKµÄÖµĪŖ ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1£®00 | 2£®00 | 0£®00 |
| 1 | 0£®90 | 1£®80 | 0£®20 |
| 3 | 0£®75 | 1£®50 | 0£®50 |
| 5 | 0£®65 | 1£®30 | 0£®70 |
| 9 | 0£®55 | 1£®10 | 0£®90 |
| 10 | 0£®55 | 1£®10 | 0£®90 |
| 14 | 0£®55 | 1£®10 | 0£®90 |
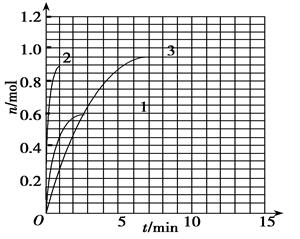
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com