
分析 (1)由(2)中混合液中H2SO4和HNO3溶液的物质的量浓度,求得C(H+),并根据公式pH=-lgC(H+),求pH;
(2)硫酸与硝酸的混合溶液,取出100mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,根据n=$\frac{m}{M}$计算硫酸钡的物质的量,再根据硫酸根守恒n(H2SO4)=n(BaSO4),根据c=$\frac{n}{V}$计算硫酸的物质的量浓度;由于滤液中氢离子物质的量不变,与4.0mol•L-1NaOH溶液反应,用去25mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-按物质的量之比1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),据此计算硝酸100mL溶液中硝酸的物质的量,进而计算100mL混合溶液中硝酸的物质的量浓度.
解答 解:(2)硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀为硫酸钡,根据硫酸根守恒故n(H2SO4)=n(BaSO4)=$\frac{9.32g}{233g/mol}$=0.04mol,故原溶液中c(H2SO4)=$\frac{0.04mol}{0.1L}$=0.4mol/L;
∵滤液中氢离子物质的量不变,与4.0mol•L-1NaOH溶液反应,用去25mL碱液时恰好完全中和,酸与氢氧化钠恰好反应,H+与OH-按物质的量之比1:1反应,故n(HNO3)+2(H2SO4)=n(NaOH),即n(HNO3)+2×0.04mol=0.025L×4mol/L,解得n(HNO3)=0.02mol,故原溶液中c(HNO3)=$\frac{0.02mol}{0.1L}$=0.2mol/L
答:混合液中H2SO4和HNO3溶液的物质的量浓度分别是0.4mol/L和0.2mol/L.
(1)C(H+)=c(HNO3)+2c(H2SO4)=0.2mol/L+2×0.4mol/L=1mol/L
∴pH=-lgC(H+)=-lg1=0
答:求混合液的pH值为0.
点评 本题考查混合物的有关计算,难度中等,注意加入氯化钡反应后溶液中氢离子的物质的量不变,注意利用守恒法解答.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解 | 该溶液中一定含有SO42- |
| B | 向某溶液中加入NaOH溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体 | 原溶液中一定含有NH4+ |
| C | 向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该溶液中一定含有CO32- |
| D | 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色未见紫色 | 原溶液中不含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
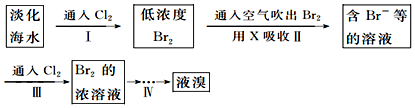
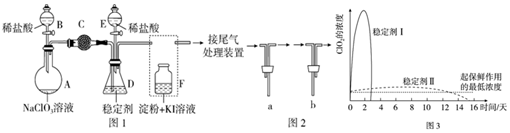
| 弱酸化学式 | HClO | H2CO3 |
| 电离常数 | K=4.7×10-8 | K1=4.3×10-7, |
| K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
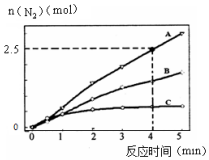 I.用NH3催化还原NxOy可以消除氮氧化物的污染.
I.用NH3催化还原NxOy可以消除氮氧化物的污染.| 温度/K | 反应① | 反应② | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖、油脂、蛋白质都可以生水解反应 | |
| B. | 天然纤维、聚酚纤维、光导纤维都属于有机高分子材料 | |
| C. | 大力实施矿物燃料脱硫、脱硝技术以减少硫、氮氧化物排放 | |
| D. | 镀锌铁或镀锡铁镀层破损后仍将通过牺牲阳极的阴极保护法防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
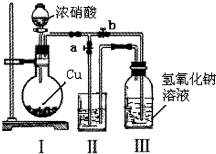 针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:
针对网络上流传的隔夜熟肉中因亚硝酸钠(NaNO2)含量严重超标而不能食用的说法,某兴趣小组开展如下探究活动:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com