
【题目】(1)5 mol的CO2与8 mol的SO2的分子数之比是________;原子数之比是________;质量比是________。
(2)KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:________KClO3+________HCl(浓)===________KCl+________ClO2↑+________Cl2↑+________H2O
①配平以上化学方程式(化学计量数填入划线上)。
②ClO2是反应的________(填“氧化”或“还原”)产物。浓盐酸在反应中显示出来的性质是(填写号码)________。
a.还原性 b.氧化性 c.酸性 d.碱性
③反应产生0.1 mol Cl2,则转移的电子的物质的量为________ mol。
④ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位质量得到电子数表示)是Cl2的________倍(保留2位小数)。
【答案】5∶85∶855∶1282 4 2 2 1 2还原ac0.22.63
【解析】
(1)5molCO2与8mol SO2的分子数之比等于物质的量之比,即5:8,二者都是三原子分子,所以原子数之比是5:8,质量之比是(5×44):(8×64)=55:128;
(2)①KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,化合价升降最小公倍数为2,故ClO2系数为2,Cl2系数为1;所以KClO3系数为2,KCl系数为2,HCl系数为4,结合元素守恒可知水的系数是2;
②KClO3氯元素的化合价降低,是氧化剂,对应的产物二氧化氯是还原产物;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高,氯元素被氧化,浓盐酸中Cl元素的化合价部分升高,部分转化为盐酸盐中,化合价不变,所以盐酸在反应中显示出来的性质是酸性和还原性,答案选ac;
③反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2,转移的电子的物质的量为0.1mol×2=0.2mol;
④设质量都是71g,氯气是1mol,得到的电子为2mol,ClO2得到的电子为![]() ,则ClO2消毒的效率是Cl2的倍数为5.26÷2=2.63。
,则ClO2消毒的效率是Cl2的倍数为5.26÷2=2.63。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知下列反应式,(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Fe3++2Br-则离子中,还原性由强到弱的排列顺序正确的是
A.Br->Fe2+>I-B.I->Fe2+>Br-C.Br->I->Fe2+D.Fe2+>I->Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中,可能含有Mg2+、Al3+、Fe2+、NH4+、H+、AlO2-、Cl-中的一种或几种离子,向其中缓慢地滴入NaOH溶液直至过量,产生沉淀的物质的量与加入的NaOH溶液体积的关系如图所示,由此确定,无色溶液中含有的离子是( )
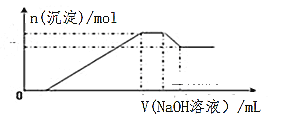
A. Mg2+、Al3+、Fe2+、Cl-
B. H+、Mg2+、Al3+、NH4+
C. H+、Mg2+、Al3+、NH4+、Cl-
D. Mg2+、NH4+、AlO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿不仅可用于火法炼铜,也可用于湿法炼铜,湿法可同时生产铜、磁性氧化铁和用于橡胶工业的一种固体物质A,流程如下:
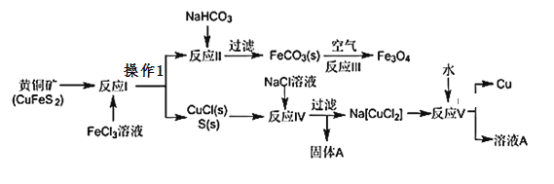
(1)黄铜矿中Cu的化合价是______,反应I中________molFeC13 可氧化0.1mol CuFeS2。
(2)实验室在进行操作1时,除使用烧杯外,还需使用的玻璃仪器有___________。
(3)工业生产中的过滤操作多采用倾析法(倾析法:先把清液倾入漏斗中,让沉淀尽可能地留在烧杯内)分离出固体物质,下列适合用倾析法的有____________。
a.沉淀的颗粒较大 b.沉淀呈胶状 c.沉淀容易沉降 d.沉淀呈絮状。
(4)固体物质A的成分________(写名称),本流程中可实现循环使用的物质除水外还有_______________
(5)反应Ⅲ是在设备底部鼓入空气,高温氧化锻烧法来制备磁性氧化铁,写出对应的化学方程式_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活、环境、材料信息关系密切,下列说法不正确的是
A. 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去
B. 有一种新发现的固态碳,这种碳的结构称为“纳米泡沫”,外形类似海绵,密度小且有磁性。这种碳与金刚石的关系是互为同素异形体
C. 聚乙炔用I2或Na 等掺杂处理后可形成一种导电塑料,该导电塑料有固定的熔、沸点
D. 工业上电解熔融的氯化钠、氯化镁、氧化铝来制取钠、镁、铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.凡是放热反应的发生均无需加热B.物质发生化学反应都伴随着能量变化
C.凡是需要加热后才能发生的反应是吸热反应D.伴有能量变化的物质变化都是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100mL溶液,向溶液中加入下列物质。有关结论正确的是
加入的物质 | 结论 | |
A | 50mL 1 mol/LH2SO4 | 反应结束后,c(Na+)=c(SO42-) |
B | 0.05molCaO | 溶液中c(OH-) /c(HCO3-) 增大 |
C | 50mL H2O | 由水电离出的c(H+)·c(OH—)不变 |
D | 0.1molNaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】初中阶段:物质得氧和失氧的反应是氧化还原反应;高中阶段:凡是有元素化合价升降的化学反应都是氧化还原反应。元素化合价升高的为还原剂,发生氧化反应;元素化合价降低的为氧化剂,发生还原反应;氧化反应和还原反应同时发生的,这样的反应称为氧化还原反应。请回答下列问题:
(1)根据化合价改变判断下列四种基本反应类型,一定不是氧化还原反应的是____。(选填宇母序号)
A.化合反应B.分解反应C.置换反应 D.复分解反应
(2)在化学反应Fe+CuSO4=Cu+FeSO4中,该反应的还原剂是_____(填化学式)。
(3)下列反应中,氧化反应与还原反应在同一元素中进行的是________。(多选,选填字母序号)
A.C12+2NaOH=NaCl+NaClO+H2OB.4P+5O2![]() 2P2O5
2P2O5
C.Zn+CuCl2=Cu+ZnCl2 D.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2可作氧化剂、催化剂和干电池中的去极化剂,通过图1装置焙烧MrCO3可以制取MnO2。
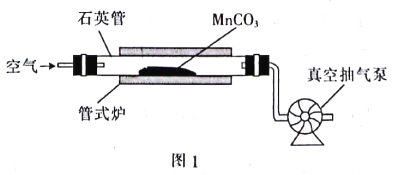
已知:2MnO(s)+O2(g)=2MnO2(s) △H1=a kJ.mol-l
MnCO3 (s)=MnO(s)+CO2 (g) △H2=b kJ.mol-l
回答下列问题:
(1)写出图1装置中制取MnO2的热化学方程式:__________(△H用含a、b的代数式表示)。
(2)一定条件下,在1L恒容密闭容器中,该反应达到化学平衡时,CO2与O2的物质的量之比为m,氧气的物质的量为2 mol,则化学平衡常数K=__________。
(3)用真空抽气泵不断抽气的目的是___________(从化学平衡的角度回答)。
(4)某科研小组对碳酸锰与空气反应制备二氧化锰的条件(焙烧温度和气氛)进行了研究,获得三幅图(如图所示)。
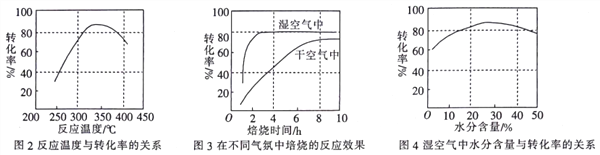
①制备时焙烧温度为________,气氛条件为________。
②图2中是在常压(0.1 MPa)下获得的数据,试在图2中用虚线画出10 MPa下反应温度与转化率的关系图。__________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com