
| A. | pH=0的溶液中:Fe2+、Na+、Cl-、NO3- | |
| B. | 无色溶液中:Ba2+、Zn2+、Cl-、NO3- | |
| C. | 加入铝粉后能产生气体的溶液中:Mg2+、Ba2+、SO32-、NO3- | |
| D. | 常温下水电离出的c(H+)=10-12的溶液中:Fe3+、K+、ClO-、SO42- |
分析 A.pH=0的溶液呈酸性;
B.离子之间不发生任何反应;
C.加入铝粉后能产生气体的溶液为强碱性或酸性溶液;
D.常温下水电离出的c(H+)=10-12的溶液可能呈酸性或碱性.
解答 解:A.pH=0的溶液呈酸性,酸性条件下Fe2+、NO3-发生氧化还原反应而不能大量共存,故A错误;
B.离子都无色,且离子之间不发生任何反应,可大量共存,故B正确;
C.加入铝粉后能产生气体的溶液为强碱性或酸性溶液,碱性条件下Mg2+不能大量共存,酸性条件下SO32-、NO3-发生氧化还原反应,故C错误;
D.常温下水电离出的c(H+)=10-12的溶液可能呈酸性或碱性,碱性条件下Fe3+不能大量共存,酸性条件下ClO-不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子的颜色、离子之间的反应为解答的关键,侧重复分解反应及氧化还原反应的离子共存考查,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | - | Cl- | |
| ② | KClO3 | 浓盐酸 | - | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| A. | 表中②组反应的还原产物是KCl,电子转移数目是6e- | |
| B. | 氧化性强弱的比较:KClO3>Fe3+>Cl2>Br2 | |
| C. | 表中①组的反应可能有一种或两种元素被氧化 | |
| D. | 表中③组反应的离子方程式为:2MnO${\;}_{4}^{-}$+3H2O2+6H+═2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 向某溶液中滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| B | 向某无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 用洁净铂丝蘸取某溶液进行焰色反应 | 火焰呈黄色 | 溶液中有K+ |
| D | 将某气体通入品红溶液中 | 品红溶液褪色 | 该气体一定是SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
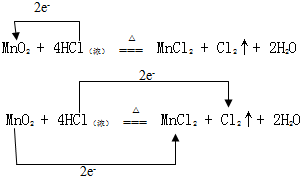 实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氯甲烷(CH3Cl) | B. | 甲基(-CH3 ) | C. | 碳负离子(CH3-) | D. | 乙烯(C2H4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2CO3>H2SiO3 | B. | 稳定性:HF<H2O<NH3 | ||
| C. | 离子半径:Na+>F->Al3+ | D. | 沸点:HI>HBr>HF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3与石灰水反应,当n(NaHCO3):n[Ca(OH)2]=3:1时,溶液中无HCO${\;}_{3}^{-}$ | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=5:1时,铝元素以AlO${\;}_{2}^{-}$形式存在 | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:1时,溶液中只有Fe3+存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com