
| ||
| ||
| ||
| 2×84 |
| 33.6g |
| 106 |
| x |
| 2×84 |
| 33.6g |
| 22.4L |
| V(CO2) |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
| A、过量①与②分别与少量的锌(大小相同)反应时,开始时刻速率相同,反应中速率:①<② |
| B、将②、③两种溶液混合后,若呈中性,则消耗溶液的体积:②>③ |
| C、等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大 |
| D、将③稀释a倍,将④稀释b倍,两溶液pH相等,则a<b倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若混合气体中各成分的浓度不再变化,则该反应已达平衡状态 |
| B、将1 mol N2和3 mol H2充入容器反应达到平衡时,放出的热量等于93.4 kJ |
| C、催化剂能缩短该反应达到平衡所需的时间,从而提高N2的转化率 |
| D、缩小容器的体积,v(正)增大、v(逆)减小,平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质发生化学反应都伴随着能量变化 |
| B、伴有能量变化的物质变化都是化学变化 |
| C、在一个确定的化学反应过程中,反应物的总能量总是高于生成物的总能量 |
| D、凡是经过加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=
提示:由8molS形成8mol S-S可推知平均1molS含有的S-S,然后计算),则Q=查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
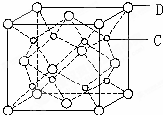 有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则:
有A、B、C、D、E五种原子序数依次增大的元素(原子序数均小于30).A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;E的原子序数为29;D与E同周期,价电子数为2.则:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L Cl2完全反应时,转移电子数一定为2NA |
| B、常温下,l LpH=l的H2SO4溶液中含有的H+的数目为0.2NA |
| C、标准状况下,2.24 L NH3中含有共价键的数目为NA |
| D、常温下,23 g NO2和N2O4的混合气体中含有NA个氧原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com