
 2CaO+O2,
2CaO+O2, 2CaO+O2;
2CaO+O2; 2CaO+O2
2CaO+O2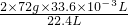 =0.216g,
=0.216g,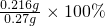 =80%,
=80%, =0.00155mol,
=0.00155mol,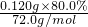 =0.00133mol,
=0.00133mol,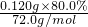 :
: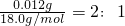
 .
. .
.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
本题分子量用以下数据:H2O=18.0 CaO=56.0 CaO2=72.0
过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水。为分析某过氧化物样品的组成,进行了如下实验。
①称取0.270克样品,灼热使之完全分解,生成CaO.O2和H2O,得到的O2在标准状况下的体积为33.6毫升。
②另取0.120克样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解。然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200摩/升KMnO4溶液滴定,共用去31.0毫升KMnO4溶液。化学方程式如下:
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2+8H2O
(1)写出CaO2受热分解的化学方程式。
(2)计算样品中的CaO2的质量分数。
(3)计算样品中的CaO2?xH2O的x值。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com