
| A. | 向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O | |
| B. | FeBr2溶液中通入等物质的量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | 酸性KMnO4溶液中加H2O2,紫色褪去:2MnO4-+H2O2+6H+=2Mn2++3O2↑+4H2O | |
| D. | 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑ |
分析 A.Mg(HCO3)2溶液中加入过量的 NaOH溶液,反应生成氢氧化镁、碳酸钠和水;
B.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,再氧化溴离子;
C.得失电子不守恒;
D.二者反应生成氢氧化铜、硫酸钠和氧气.
解答 解:A.向Mg(HCO3)2溶液中加入过量的 NaOH溶液,离子方程式:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O,故A正确;
B.FeBr2溶液中通入等物质的量Cl2,离子方程式:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,故B正确;
C.酸性KMnO4溶液中加H2O2,紫色褪去,离子方程式:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,故C错误;
D.向CuSO4溶液中加入Na2O2,离子方程式:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑,故D正确;
故选:C.
点评 本题考查了离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意离子方程式遵循客观事实、遵循电荷守恒、得失电子守恒规律,注意反应物用量对反应的影响,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 原子核内有7个中子的碳原子:${\;}_6^{13}C$ | |
| B. | HF的电子式: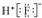 | |
| C. | CH4分子的球棍模型: | |
| D. | Cl-离子的结构示意图: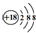 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有③ | B. | 只有① | C. | ①和② | D. | 都正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
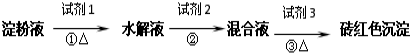
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$的值增大 | |
| B. | pH=4的CH3COOH溶液和pH=12的NaOH溶液等体积混合后恰好完全反应,则原CH3COOH溶液中CH3COOH的电离度为1% | |
| C. | amol•L-1H2C2O4溶液与2amol•L-1的NaOH溶液等体积混合后,c(C2O42-)>c(HC2O4-)>c(H2C2O4)>c(OH-) | |
| D. | 0.1mol•L-1的下列溶液中:①NH4Al(SO4)2溶液 ②NH4Cl溶液、③CH3COONH4溶液,c(NH4+)的大小顺序为①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+Na+Cu2+Al3+ |
| 阴离子 | SO42- HCO3-NO3-OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 绿色化学的核心是利用化学原理治理环境污染 | |
| C. | 将煤气化或液化,获得清洁燃料 | |
| D. | 向高空排放金属冶炼产生的粉尘 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
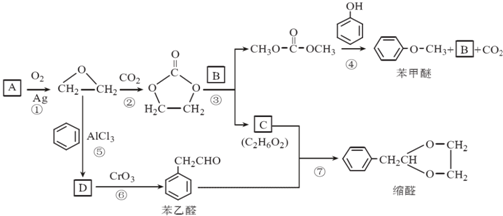
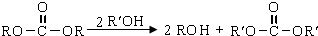
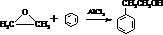 .
.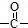 结构的苯乙醛的所有同分异构体的结构简式:
结构的苯乙醛的所有同分异构体的结构简式: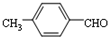 、
、 .
.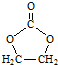 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备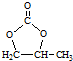 的合成路线(注明必要的反应条件)
的合成路线(注明必要的反应条件)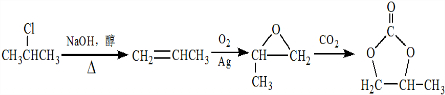 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com