

分析 (1)根据根据SO42-、Ca 2+、Mg2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
(2)①电解池中和电源的正极相连的是电解池的阳极,发生失电子的氧化反应;阳离子交换膜只允许阳离子通过,而阴离子不能通过;
②氯化镁失水发生水解生成氢氧化镁沉淀,为防止水解应在氯化氢气流中加热脱水;
(3)苦卤中通入Cl2已经置换出Br2,吹出后用SO2吸收转化为Br-再用Cl2置换是为了富集溴元素,在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性;
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,生成溴化钠和溴酸钠,在酸溶液中会反应归中反应.
解答 解:(1)SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸,所以正确顺序为:BaCl2、NaOH、Na2CO3、HCl,
故答案为:BaCl2、NaOH、Na2CO3、HCl;
(2)①阳离子交换膜只能阳离子通过,阴离子和气体不能通过,用石墨作电解电解饱和氯化钠时,阳极上氯离子放电生成氯气,氯气不能通过阳离子交换膜而进入阴极,如果氯气进入阴极易和氢气混合产生爆炸,且易和氢氧化钠溶液反应生成氯化钠、次氯酸钠而导致制取的氢氧化钠不纯,电解饱和食盐水反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH,
故答案为:阻止H2与Cl2发生反应甚至发生爆炸或阻止Cl2与生成的NaOH溶液反应而使烧碱产品不纯; 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2NaOH;
②氯化镁在水中乙发生水解,为抑制水解,氯化镁晶体应在氯化氢气流中脱水,故答案为:在HCl气流中加热脱水(防止MgCl2水解);
故答案为:防止MgCl2水解;
(3)苦卤中通入Cl2已经置换出Br2,吹出后用SO2吸收转化为Br-再用Cl2置换是为了富集溴元素,第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用,在自发进行的氧化还原反应中,还原剂的还原性大于还原产物的还原性,氧化剂氧化性大于氧化产物,
Cl2+2 Br-=Br2+2Cl-中还原性 Br->Cl-,SO2+2H2O+Br2=H2SO4+2HBr中还原性SO2>Br-,所以还原性强弱顺序是 SO2>Br->Cl-,氧化性强弱顺序为:Cl2>Br2>SO2,
故答案为:第一次吹出的Br2浓度太低,分离浪费原料,SO2吸收主要起到富集作用 Cl2>Br2>SO2
(4)吹出Br2后用碳酸钠溶液吸收,形成溴化钠和溴酸钠,同时有CO2放出,反应的离子方程式为:3Br2+3CO32-═5Br-+BrO-3+3CO2↑,生成溴化钠和溴酸钠,最后再用H2SO4处理得到Br2,说明溴离子和溴酸根离子在酸溶液中发生氧化还原反应生成溴单质,反应的离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O;
故答案为:3Br2+3CO32-═5Br-+BrO-3+3CO2↑;5Br-+BrO3-+6H+═3Br2+3H2O.
点评 本题考查了离子性质的应用,混合物除杂的实验方案分析,氧化还原反应的强弱规律应用,归中反应的分析判断,离子方程式的书写方法,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
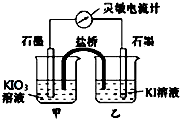 将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池.
将反应IO3-+5I-+6H+?3I2+3H2O设计成如图所示的原电池.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含Ba(OH)2、KOH的混合溶液中缓慢通入CO2:Ba(OH)2、KOH、K2CO3、BaCO3 | |
| B. | 在含NH4+、Al3+、H+的溶液中逐滴加入KOH溶液:H+、Al3+、NH4+、Al(OH)3 | |
| C. | 在含AlO2-、OH-、CO32-的溶液中逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32- | |
| D. | 在含等物质的量的Fe2+、Ag+、Cu2+、H+的溶液中加入锌粉:Ag+、Cu2+、H+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
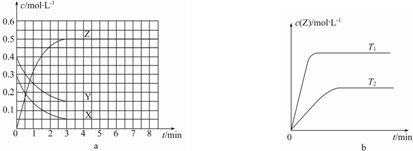
| A. | 该反应的正反应是放热反应 | |
| B. | 若在第6 min时升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 反应中某时刻各物质的正反应速率为2v(X)═2v(Y)═v(Z) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
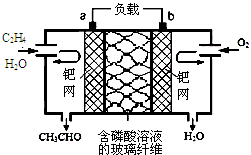 乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.| A. | 该电池可以实现化学能和电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 正极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 每有1mol 乙烯反应,则迁移2 mol H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
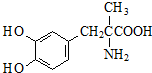
| A. | 分子式为C10H14NO4 | |
| B. | 分子中有一个手性碳原子 | |
| C. | 甲基多巴具有两性,且能发生酯化反应 | |
| D. | 1mol甲基多巴分子最多能与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

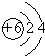 ;元素②的最高价氧化物结构式为:O=C=0;
;元素②的最高价氧化物结构式为:O=C=0;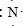 →
→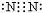 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com