
下列溶液中含Cl-浓度最大的是
| A.10mL 0.1mol·L-1的氯化铝溶液 |
| B.30mL 0.1mol·L-1的氯化钙溶液 |
| C.30mL 0.2mol·L-1的氯化钾溶液 |
| D.40mL 0.25mol·L-1的氯化钠溶液 |
科目:高中化学 来源: 题型:单选题
等物质的量的N2、O2、CO2混合气体通过Na2O2后,体积变为原体积的8/9(同温同压),这时混合气体中N2、O2、CO2的物质的量之比为
| A.3:4:1 | B.3:3:2 | C.6:7:3 | D.6:9:0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入5 mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法正确的是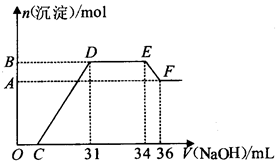
| A.溶液中结合OH-能力最强的离子是NH4+ |
| B.D点时溶液中存在:c(NH4+)+c(H+)=c(OH-)+c(NO3-) |
| C.合金中n(Fe) :n(Al)=1 :3 |
| D.C的值为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏伽徳罗常数的值,下列说法正确的是( )
| A.常温常压下,26g乙炔含有的∏键数目为3NA |
| B.7.8gNa2O2中所含阴离子的数目是0.2NA |
| C.标准状况下,2.24Ll8O2中所含中子的数目是2NA |
| D.在密闭容器中盛有0.lmolN2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.0.1 mol Fe在0.1mol CL2中充分燃烧,转移的电子数为0.3NA |
| B.标准状况下,11.2 L CCl4所含分子数约为0.5NA |
| C.常温下,pH=13的NaOH溶液中,OH-的数目为0.1NA |
| D.常温、常压下,14g CO与N2的混合气含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将Mg、Cu组成的混合物26.4g投入到适量的稀硝酸中,固体完全溶解,收集到标准状况下的NO气体8.96L,向反应后的溶液中加入过量的5mol·L-1的NaOH溶液300mL,金属离子完全沉淀。则形成沉淀的质量是 ( )
| A.43.2g | B.46.8g | C.53.6g | D.63.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。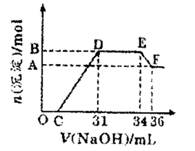
分析上述图形,下列说法不正确的是
| A.OC段离子反应方程式:H+十OH-=H2O |
| B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
| C.溶液中n(NH4+)=0.012mol |
| D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
| | 一氧化氮 | 硝酸 | 转移的电子 |
| A. | 1mol | | 2NA |
| B. | 11.2L | 1mol | |
| C. | | 63g | 2mol |
| D. | | 1mol | NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com