
【题目】室温下某溶液中由水电离产生的c(H+)等于10-10mol·L-1,该溶液的溶质不可能是( )
A.NaHSO4B.NaClC.HClD.Ba(OH)2
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】下列有关氯元素及其化合物的表示正确的是
A. 质子数为17、中子数为20的氯原子:2017ClB. 次氯酸的结构式:H-Cl-O
C. 氯分子的电子式:![]() D. 氯乙烯分子的结构简式:H3C—CH2Cl
D. 氯乙烯分子的结构简式:H3C—CH2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定能在下列溶液中大量共存的离子组是( )
A. 水电离产生的H+浓度为1×10-12 mol·L-1的溶液:Na+、Fe2+、Cl-、NO3-
B. 能使pH试纸变深蓝色的溶液:Na+、AlO、S2-、CO![]()
C. 含有大量Fe3+的溶液:SCN-、I-、K+、Br-
D. 加入活泼金属Al能产生H2的溶液:K+、NH、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。有人模拟用CO和H2合成甲醇,其反应为:CO(g) + 2H2(g) CH3OH(g) △H<0
(1)在容积固定为1L的密闭容器内充入2 mol CO和4 mol H2发生上述反应,20min时用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 |
压强/MPa | 12.4 | 10.2 | 8.4 | 7.0 | 6.2 | 6.2 |
则反应从开始到20min时,以CO浓度变化表示的平均反应速率v(CO)=_________mol/(L·min),该温度下平衡常数K=___________,若平衡后增大压强,则K值_________(填“增大”、“减小”或“不变”)。
(2)在恒温恒容的密闭容器中,不能判定CO(g)+2H2(g) CH3OH(g) △H<0,反应达到平衡的是___________;
A、压强保持不变 B、气体的密度保持不变
C、气体平均摩尔质量保持不变 D、速率v(H2):v(CH3OH)=2:1
(3)如图是甲醇燃料电池结构示意图,C是________(填“正”或“负”)极,写出此电极的电极反应式__________________________________________。

(4)若以该电池为电源,用石墨做电极电解100mL CuSO4溶液,电解一段时间后,两极均收集到11.2L的气体(标准状况下),则原CuSO4溶液的物质的量浓度为________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O32-+O2+4OH- = Fe3O4↓+S4O62-+2H2O。下列说法不正确的是
A. 参加反应的氧化剂与还原剂的物质的量之比为1∶5
B. 若有2 mol Fe2+被氧化,则被Fe2+还原的O2的物质的量为0.5 mol
C. 每生成1 mol Fe3O4,反应转移的电子为4 mol
D. O2是氧化剂,S2O32-与Fe2+是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝合金溶于100mL稀硝酸中,产生1.12LNO气体(标准状况),向反应后的溶液中加入NaOH溶液,产生沉淀情况如图所示。下列说法不正确的是

A. 原溶液中c(HNO3)=2.6mol/L B. 沉淀最大质量为4.08g
C. m(Mg):m(Al)=8:9 D. 氢氧化钠溶液浓度为3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9 g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到5.05g沉淀,对样品所含杂质的正确判断是
A. 肯定有Na2CO3,没有Ba(NO3)2 ,可能有有KNO3
B. 肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3
C. 肯定没有Na2CO3和Ba(NO3)2,可能有KNO3
D. 以上判断都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,11.2 L的SO3中含有的电子数为20NA
B. 88g CO2和N2O组成的混合气体中所有的原子数为6NA
C. 2mol NO和 1mol O2充分反应后所得气体分子数为2NA
D. 常温下,1L 0.1molL-1的 Na2S 的溶液中,阴离子的总数小于0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有关研究需要得到反应C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:
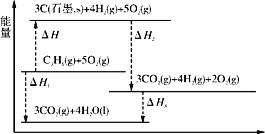
①ΔH______0(填“>”、“<”或“=”)。
②ΔH=____________________(用图中其他反应的反应热表示)。
(2)已知在压强为a MPa、500℃下,2 mol H2和1 mol CO2在某密闭容器中反应,生成水和气态二甲醚CH3OCH3 。其中CO2的转化率为60%,此过程中放出0.3Q kJ热量。此反应的热化学方程式为_____________。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/(kJ·mol-1) | 198 | 360 | 498 | x |
已知,白磷在空气中燃烧生成P4O10,白磷的燃烧热为2 982 kJ·mol-1,白磷(P4)、P4O10结构如图所示,则上表中x=____。
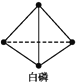
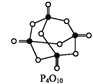
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com