
����Ŀ���������ڻ�ѧ��Ӧǰ�������ͻ�ѧ���ʲ�����������о����������������ͽ������̡�
(1)��ͨ����N2��H2�����ͽ�������Ϊ�ϳɰ��Ĺ������������![]() �ֱ��ʾN2��H2��NH3�������,���ڹ����������ϳɰ��Ĺ��̿���ͼ1��ʾ��
�ֱ��ʾN2��H2��NH3�������,���ڹ����������ϳɰ��Ĺ��̿���ͼ1��ʾ��

��������������״̬��͵���________________(����ĸ���)��
��������ԭ���������������NH3�ķֽ�ʵ�������ַֽ�������Ũ�ȹ�ϵ��ͼ2���������ͽ������̷�����c0ǰ�������ӵ�ԭ�������____________________��c0�����ʽ��͵�ԭ�������_______________________________________________��
(2)�������̿�����Ϊ��������ֽ�Ĵ�������д�������������¶������̲����������ֽ�����ӷ�Ӧ����ʽ____________________��___________________��
(3)�������ʵ�����N2��H2����һ�ܱ������з�����Ӧ���ﵽƽ�����N2���������Ϊ_______��
���𰸡� C ��������NH3Ũ�ȵ����ӣ����������������ߣ�����NH3Ũ�����ӣ�NH3�ķֽ����ʼӿ� ���������ﵽ���ͣ�ͬʱ�����ڽ�����NH3�ķֽ����ʽ��� MnO2+H2O2+2H+=Mn2++2H2O+O2�� Mn2++H2O2=MnO2��+2H+ 50%
��������
��1�������ڻ�ѧ���Ķ���Ҫ�����������ʻ״̬B���������ڳ�ʼ״̬A�����������˷�ӦΪ���ȷ�Ӧ���ʳ�ʼ״̬A����������ĩ̬C����������C��������ͣ�
��c0ǰ����Ũ�����ӣ����·�Ӧ���ʼӿ죻c0�����ڰ�����Ũ��̫���谭N2��H2�Ľ������ʷ�Ӧ���ʼ�����
��2�����������������ԣ����������������������������ɵ���������3����������������+4�۵Ķ������̣����Է�ӦΪMnO2+H2O2+2H+��Mn2++2H2O+O2����Mn2++H2O2=MnO2��+2H+��
��3���赪���������ij�ʼ��Ϊ1mol����Ӧ���������ʵ���xmol����
N2��g��+3H2��g��2NH3��g��
��ʼ����mol��1 1 0
ת������mol��x 3x 2x
ƽ������mol��1-x 1-3x 2x
��N2���������Ϊ![]() ��
��


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���X�ļ���ʽ������ʾ������˵���в���ȷ����( )
![]()
A. X�ķ���ʽΪC8H8
B. �л���Y��X��ͬ���칹�壬�����ڷ���������Y�Ľṹ��ʽΪ![]()
C. X��ʹKMnO4������Һ��ɫ
D. X��������H2��һ�������·�Ӧ�����ɻ�״�ı�����Z��Z��һ�Ȼ�����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ��̬����������ܶȸߡ��ɱ��ͣ��乤��ԭ����ͼ��ʾ�����е缫 a���ò���ʯīϩ��S8���ϣ���ط�ӦΪ��16Li+xS8=8Li2Sx��2��x��8��������˵��������ǣ� ��

A. ��ع���ʱ�������ɷ�����Ӧ��2Li2S6+2Li++2e-=3Li2S4
B. ��ع���ʱ�����·������ 0.02 mol ���ӣ��������ϼ��� 0.14 g
C. ʯīϩ��������Ҫ����ߵ缫a�ĵ�����
D. ��س��ʱ��Խ���������Li2S2����Խ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ�ũҵ�������ճ�����������Ҫ��;��

��1����ͼΪ�����Ƶ������ͼ����������պ���ʱ������Ҫ���ż��⣬����Ҫ�õ���ʵ��������_____________��������������ѡ��������������ñ����ĸ��д����
A.�ձ�B.����C.������D.������E.�ƾ���F.������
����ܷ�����Ӧ�����ӷ���ʽΪ____________________________________��
��2��������ݲ����ѻ�������ȡ�⣬�����__________________________��
��3���廯�⣨IBr���Ļ�ѧ����������±�ص��ʣ�����������������Ӧ���ɽ���±�����ˮ��Ӧ�ķ���ʽΪ��IBr+H2O==HBr+HIO�ȣ������й�IBr�������д��������____����
A.�����廯���۷е�ϸ�
B.�����෴Ӧ�У��廯����ǿ������
C.��±�ص������ƣ���ˮ��Ӧʱ���廯����������������ǻ�ԭ��
D.�廯���NaOH��Һ��Ӧ����NaBr��NaIO��H2O
��4��Ϊʵ���й�������ȱ������Ŀ�ꡣ�������涨ʳ�α���ӵ��Σ����еĵ��Ե���أ�KIO3�����ڡ������������ữ�ĵ⻯�ص�����Һ����ӵ��Σ�����˵����ȷ������____����
A.���������л��ܼ������þƾ���ȡ��ˮ�е�I2
B.����ӵ���ԭ����IO3��+5I��+3H2O ===3I2+6OH��
C.��KIO3��Һ�м��뼸�ε�����Һ����Һ����ɫ
D.��ij��ɫ��Һ�м�����ˮ�����Ȼ�̼�������ã��²����ɫ��˵��ԭ��Һ����I��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����������A������Է�������Ϊ104��̼����������Ϊ92.3%��
��1��A�����������__________________��ԭ����ͬһ��ƽ���ϡ�
��2��A��������Ȼ�̼��Һ��Ӧ�Ļ�ѧ����ʽΪ________________��
��3����һ�������£�A��������Ӧ���õ��Ļ�������̼����������Ϊ85.7%��д���˻�����Ľṹ��ʽ________________��
��4����һ�������£���A�ۺϵõ��ĸ߷��ӻ�����Ľṹ��ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ɫ���ļ�����Һ�У��ܴ���������������ǣ� ��
A.Na+��H+��SO42����HCO3��
B.Cu2+��K+��SO42����NO3��
C.Na+��K+��Cl����NO3��
D.Mg2+��K+��SO42����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ2A+2B![]() 3C+D��ͬ�����µķ�Ӧ���ʣ���Ӧ����������( )
3C+D��ͬ�����µķ�Ӧ���ʣ���Ӧ����������( )
A. v(A)= 0.55mol (L��min) B. v(B)= 0.6mol/(L��s)
C. v(C)=0.75mol/(L��min) D. v(D)== 0.4mol/ (L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����顢��Ļ�������;�dz��㷺���ش��������⣺
��1����̬��ԭ�ӵļ۵��ӹ������ʽ�������Ų�ͼ��Ϊ_______________����δ�ɶԵ�������ԭ�ӵĹ������ͼ��Ϊ____________________��
��2��B4C���۵�Ϊ2350 �桢�е�Ϊ3500 �棬˵��������____________���壬AsF3�ķе㣨60.4�棩��SbF3�ķе㣨376�棩�ͣ���ԭ����____________________________________��
��3����֪��Ӧ��(CH3)3C��F+SbF6��(CH3)3CSbF6���÷�Ӧ������(CH3)3C+����̼��������̼ԭ���ӻ���ʽ��____________________________________��
��4����BF3��Ϊ�ȵ�����ķ��Ӻ����ӷֱ�Ϊ_______________������1��������֪�����еĴ�м����÷���![]() ��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�����(�籽�����еĴ�м��ɱ�ʾΪ
��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�����(�籽�����еĴ�м��ɱ�ʾΪ![]() )����BF3�еĴ�м�Ӧ��ʾΪ_________________��
)����BF3�еĴ�м�Ӧ��ʾΪ_________________��
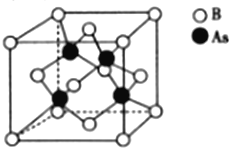
��5���黯��ľ����ṹ��ͼ��ʾ������ԭ�ӽ��ڵ���ԭ����_________������ÿ����ԭ�ӽ��ڵ���ԭ����_________�������侧������Ϊbpm�����侧����ܶ�Ϊ_________________(�г�����ʽ����NAΪ�����ӵ���������ֵ)g��cm-3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��a��b��c��d��Ϊʯī�缫��ͨ����е�⣬����˵����ȷ����(�� ��)
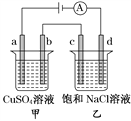
A. ��·�е�����������d��c��b��a������
B. a��c����������������ʵ������
C. SO42-��b�缫�˶���Cl-��c�缫�˶�
D. ͨ������ձ������̪��Һd������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com