
时间(h) 钾元素 温度 熔出率 |
1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830℃ | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890℃ | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950℃ | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
 ,
, ;
;| 0.699mol×58.5g/mol |
| 556g |


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、从原料消耗的角度来看,a路线制氢更有价值 |
| B、从能量消耗的角度来看,b路线制氢更加有利 |
| C、a路线制氢由于要消耗很多能量,所以在实际生产中意义不大 |
| D、降低温度,可提高b路线中乙醇的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸钠溶液通入少量SO2 2 CO32-+SO2+H2O═2 HCO3-+SO32- |
| B、NaHSO4 溶液和Ba(OH)2溶液反应呈中性 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
| C、NaClO溶液FeCl2溶液混合 2ClO-+Fe2++2H2O═Fe(OH)2↓+2HClO |
| D、NH4Al(SO4)2溶液中加入少量氢氧化钠溶液 NH4++OH-=NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol?L-1的NaClO溶液中所含ClO-的数目为NA | ||
B、常温常压下,1g氧气含O2分子数目为
| ||
| C、1mol Na2O2晶体中含阴、阳离子总数为4NA | ||
| D、将11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度 (mol/L) |
NaOH物质的量浓度 (mol/L) |
混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
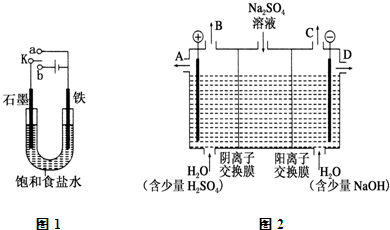 (1)某课外活动小组同学用如图1装置进行实验,试回答下列问题:
(1)某课外活动小组同学用如图1装置进行实验,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

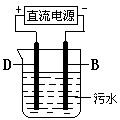
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液中:2c(R2-)+c(HR-)=c(Na+) |
| B、若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH=9,则:c(OH-)-c(HY)=c(H+)=1×10-9mol/L |
| C、0.2mol?L-1 HCl溶液与等体积0.05 mol?L-1 Ba(OH)2溶液混合后,溶液的pH=1 |
| D、NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com