
现欲用碳酸钙固体和稀盐酸反应制取CO2气体。请回答下列问题。
(1)写出发生反应的离子方程式:_________________________________________。
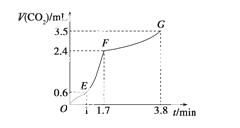
(2)实验过程中绘制出生成CO2的体积V(CO2)与时间t的关系如下图所示。试分析判断OE段、EF段、FG段反应速率[分别用v(OE)、v(EF)、v(FG)表示]的大小关系为____________;比较OE段和EF段,说明EF段速率变化的主要原因:
________________________________________________________________________。
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:
下列关于金属冶炼的说法正确的是
A.金属冶炼的本质是将化合态金属还原为游离态,冶炼方法由金属的活泼性决定
B.Cu的湿法冶炼是将金属钠投入到CuSO4溶液中,从而置换出铜
C.Fe通常采用热还原法冶炼,加入石灰石的目的是除去过量的碳
D.由于Al的活泼性强,故工业上采用电解熔融AlCl3的方法生产Al
查看答案和解析>>
科目:高中化学 来源: 题型:
饮用水中的NO 对人类健康会产生危害,为了降低饮用水中NO
对人类健康会产生危害,为了降低饮用水中NO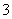 的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO
的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO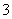 还原为N2,其化学方程式为:Al + NaNO3 + NaOH — NaAlO2 + N2↑+ H2O (未配平)。请回答下列问题:
还原为N2,其化学方程式为:Al + NaNO3 + NaOH — NaAlO2 + N2↑+ H2O (未配平)。请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元素的原子________(填“得到”或“失去”)电子;而________元素的化合价降低,则该元素的原子被________(填“氧化”或“还原”)。
(2)配平上述反应:
Al + NaNO3 + NaOH = NaAlO2 + N2↑+ H2O
(3)用“双线桥法”表示反应中电子转移的方向和数目:
___________________________________________________________。
(4)上述反应中若标准状况下产生11.2 L气体物质,则转移电子的数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应CO(g)+H2O(g)  CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下( )
A.加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B.改变压强,平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中存在如下反应:
2SO2(g)+O2(g) 2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
2SO3(g) ΔH<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是 ( )
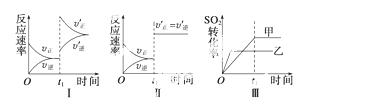
A.图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C.图Ⅲ表示的是催化剂对化学平衡的影响,且甲的催化效率比乙高
D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
科目:高中化学 来源: 题型:
经测定,H2O2为二元弱酸,其酸性比碳酸弱,它在碱性溶液中极不稳定,易分解生成H2O和O2。若向Na2O2中通入干燥的CO2气体,Na2O2与CO2并不起反应。
(1)写出H2O2在水溶液中的电离方程式
(2)用化学方程式表示Na2O2和潮湿的CO2气体反应的过程。
查看答案和解析>>
科目:高中化学 来源: 题型:
丙二酸(H2A)的pKa1 = 2.86,pKa2 = 5.70,向20.00 mL Na2A、NaHA混合溶液中加入1.00 mL 0.0100 mol·L-1 HCl,pH为5.70;滴入同样浓度10.00 mL HCI,pH为4.28,求初始混合液中Na2A、NaHA浓度和pH。
查看答案和解析>>
科目:高中化学 来源: 题型:
在碱性溶液中能大量共存且为无色透明的溶液是( )
|
| A. | K+、Cl﹣、MnO4﹣、SO42﹣ | B. | Na+、Cu2+、NO3﹣、CO32﹣ |
|
| C. | Na+、NO3﹣、SO42﹣、HCO3﹣ | D. | Na+、SO42﹣、Cl﹣、NO3﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值.下列说法正确的是( )
|
| A. | 标准状况下,40g SO3的体积为11.2L |
|
| B. | 高温下,0.2molFe与足量水蒸气反应,生成的H2分子数目为0.3 NA |
|
| C. | 5NH4NO3 |
|
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com