
【题目】南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为28°(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请思考下列问题:
(1)该泉水属于________硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂添加时先加________后加________,原因是______________________。
(3)目前常用阳离子交换树脂如NaR、HR来进行水的软化,若使用HR作为阳离子交换树脂,则水中的Ca2+、Mg2+与交换树脂的________起离子交换作用。若使用NaR作为阳离子交换树脂,失效后可放入5%~8%________溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。下面是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO等离子,电极为惰性电极。请分析下列问题:
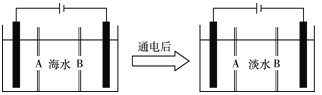
① 阳离子交换膜是指________(填A或B)。
②写出通电后阳极区的电极反应式:__________;阴极区的现象是:____________。
【答案】(1)永久 (2)石灰 纯碱 过量的钙离子可通过纯碱沉淀下来 (3)H+ NaCl (4)①B
②2Cl--2e- =Cl2↑ 电极上产生无色气体,溶液中出现少量白色沉淀
【解析】
试题分析:(1)由较多钙离子和镁离子以及硫酸根离子引起的硬水,属于永久硬水。
(2)纯碱除了除去原溶液中的Ca2+还要除去加入的Ca2+,因此一定把纯碱放在石灰的后面加入。
(3)利用阳离子交换原理,将失效后的NaR放入NaCl的溶液中,使其获得再生。
(4)①通电后,阳离子Na+向着阴极移动,故B为阳离子交换膜;
②电解时,阴离子Cl-在阳极失电子生成Cl2,电极反应式为2Cl--2e- =Cl2↑;阴极区H+得电子,生成H2同时产生OH-,与Mg2+和Ca2+反应生成氢氧化镁和氢氧化钙沉淀。


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】电镀废水中常含有NaCN,工业上规定其含量低于0.5 mg/L才可排放,对NaCN超标的废水可用两段氧化法处理:

己知:HCN的酸性比碳酸的酸性弱,有剧毒;HCN、HOCN中N元素的化合价相同。
请回答下列问题:
(1)第一次氧化时,溶液的pH应调节为______(填“酸性”、“碱性”或“中性”);原因是___________。反应中,欲使1 mol NaCN变为NaOCN,则需要氧化剂NaClO至少为________mol。
(2)写出第二次氧化时发生反应的离子方程式:_____________________。反应中被氧化的元素是__________。
(3)处理10 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO__________g(实际用量应为理论值的4倍),才能使废水中NaCN含量达到排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是 ( )

X | Y | Z | |
① | Cu | CuO | Cu(OH)2 |
② | CH3CH2OH | CH3CHO | CH2=CH2 |
③ | Na2CO3 | NaOH | NaHCO3 |
④ | CaCO3 | CaO | Ca(OH)2 |
A.②③ B.③④ C.②④ D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将磷肥生产中形成的副产物石膏(CaSO4·2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义。以下在石膏转化为硫酸钾和氯化钙的工艺流程示意图。

(1)本工艺中所用的原料除CaSO4·2H2O外,还需要____________等原料。
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:__________________。
(3)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液。检验滤液中含有CO32—的方法是:_______________。
(4)氯化钙结晶水合物(CaCl2·6H2O)是目前常用的无机储热材料,选择的依据是________。
a.熔点较低(29 ℃熔化) b.能导电 c.易溶于水 d.无毒
(5)上述工艺流程中体现绿色化学理念的是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列广告用语在科学上没有错误的是 ( )
A.这种饮料中不含任何化学物质
B.这种蒸馏水绝对纯净,其中不含任何离子
C.这种口服液含丰富的氮、磷、锌等微量元素
D.没有水就没有生命
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生活、社会可持续发展密切相关。下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
A. ①③⑤ B. ②③⑤ C. ①②④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业尾气SO2有多种吸收和处理方法。

(1)亚硫酸钠吸收法
写出Na2SO3溶液吸收SO2的离子方程式:________________。
(2)电化学处理法
①如图所示,Pt(1)电极的反应式为:____________________。
②当电路中转移0.02 mol e-时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加________mol离子。
(3)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体可以制备工业产品保险粉(Na2S2O4),同时生成二氧化碳气体,写出该反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,能使溴水褪色;A是一种重要的化工原料,它的产量通常用来衡量一个国家石油化工水平.现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如图所示:

请回答下列问题:
(1)写出A的电子式 .
(2)B、D分子中的官能团名称分别是 、 .
(3)写出下列反应的化学方程式并指出反应类型:
① 反应类型 ;
② 反应类型 ;
④ 反应类型 。
⑤ 反应类型 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com