
| A. | 98.32kJ | B. | 196.64kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
分析 由SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol可知,2molSO2和1molO2完全反应放出的热量为98.32kJ×2=196.64kJ,在容器中充入2molSO2和1molO2充分反应,发生可逆反应,不能完全转化,以此来解答.
解答 解:由SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol可知,2molSO2和1molO2完全反应放出的热量为98.32kJ×2=196.64kJ,在容器中充入2molSO2和1molO2充分反应,发生可逆反应,不能完全转化,参加反应的SO2小于2mol,则放出的热量<196.64kJ,
故选C.
点评 本题考查反应热与焓变,为高频考点,把握热化学方程式的意义、可逆反应的特征为解答的关键,侧重分析与应用能力的考查,注意物质的量与热量成正比,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾、硫酸铜、澄清石灰水 | B. | 水、空气、纯碱 | ||
| C. | 氧化铁、空气、熟石灰 | D. | 硝酸、食盐水、烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化亚铁与稀盐酸反应:FeO+2H+═Fe3++H2O | |
| B. | 硫酸滴在铜片上:Cu+2H+=Cu2++H2↑ | |
| C. | 硫酸溶液和氢氧化钡溶液反应:Ba2++SO42-═BaSO4 | |
| D. | 硝酸银溶液与氯化钠溶液反应:Ag++Cl-═AgCl↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用量筒量取KMnO4溶液12.00mL | |
| B. | 测定中和热时将NaOH溶液迅速一次性倒入盛有盐酸的小烧杯中,盖好盖板 | |
| C. | 常温下,测得0.01mol/LNaHCO3溶液的pH值=12 | |
| D. | 加热蒸发FeCl3溶液,获得FeCl3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
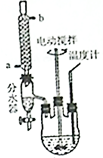 某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下:
某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下: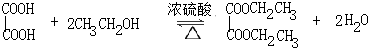 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管准确量取20.00 mL的高锰酸钾溶液 | |
| B. | 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高 | |
| C. | 用NaOH滴定盐酸时,只能用酚酞作指示剂 | |
| D. | 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
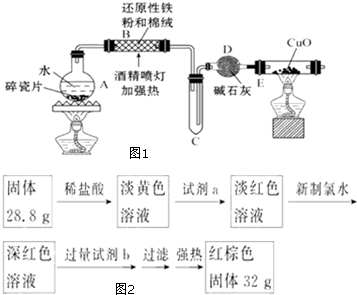 某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
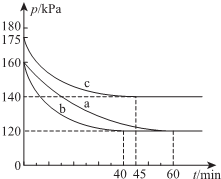 一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com