
| A. | 0.5 mol白磷(P4,结构如图)含有2NA个P-P键 | |
| B. | 23g钠与在一定条件下与氧气作用,若两者均无剩余,转移NA个电子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA个,NH+4少于2NA个 | |
| D. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |
分析 A、根据白磷的结构式可知,白磷中含6条P-P键;
B、求出钠的物质的量,然后根据钠反应后变为+1价来分析;
C、溶液体积不明确;
D、常温常压下,气体摩尔体积大于22.4L/mol.
解答 解:A、白磷的结构式可知,白磷中含6条P-P键,故0.5mol白磷中含3NA条p-p键,故A错误;
B、23g钠的物质的量为1mol,而钠反应后变为+1价,故1mol钠转移NA个电子,故B正确;
C、溶液体积不明确,故溶液中的硫酸根和铵根离子的个数无法计算,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化碳的物质的量小于1mol,由于二氧化碳中的+4价的碳元素和镁反应后变为0价,故反应后转移的电子数小于4NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:选择题
| A. | 足量铁在1molCl2中燃烧时转移电子数为2NA | |
| B. | 2L0.1mol•L-1氯化钾溶液中阴离子所带电荷数为NA | |
| C. | 1L0.1mol•L-1的Na2CO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 标准状况下,体积各为2.24L的HCl和NH3混合气体中含有的共价键数为0.25NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用于洗去铁屑表面的油污 | |
| B. | 铝易发生钝化,可用于作飞机、火箭的结构材料 | |
| C. | 炭具有还原性,可用于冶炼钠、镁、铝等金属 | |
| D. | 浓硫酸具有强氧化性,可用于干燥二氧化硫气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
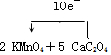
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
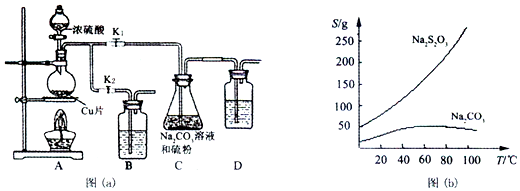
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com