
A.负极反应为2O2+2H2+4e-![]() 4OH-
4OH-
B.负极反应为CH4+10OH--8e-![]()
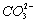 +7H2O
+7H2O
C.随着放电的进行,溶液的pH不变
D.甲烷燃料电池的能量利用率比甲烷燃烧的能量利用率大
 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH- C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
查看答案和解析>>
科目:高中化学 来源: 题型:
 零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首.其中最具代表意义的质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极.下列说法中不正确的是( )
零排放燃料电池曾被美国《时代》杂志列为21世纪改变人类生活的十大新科技之首.其中最具代表意义的质子交换膜燃料电池的工作原理如图所示,其中电极a、b均为多孔活性铂电极.下列说法中不正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)0.1mol/LNa2CO3溶液呈
(1)0.1mol/LNa2CO3溶液呈查看答案和解析>>
科目:高中化学 来源: 题型:
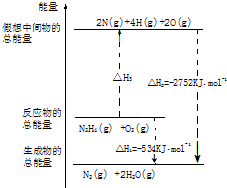 氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:
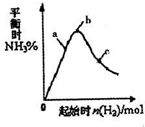 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.
工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等.| 1 | 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com