
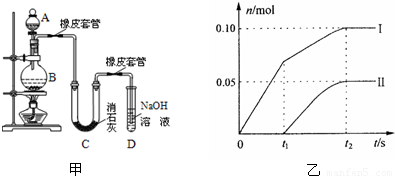


科目:高中化学 来源: 题型:阅读理解
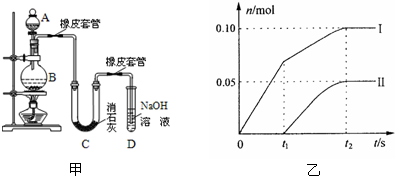
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河南省偃师高级中学高一下学期第二次月考化学试卷(带解析) 题型:实验题
I甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题: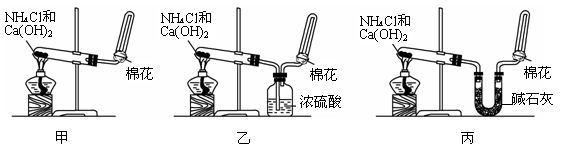
(1)三位同学制取氨气的化学方程式为:_____________________________________________。
(2)三位同学用上述装置制取氨气时,其中乙同学没有收集到氨(如果他们的实验操作都正确),你认为收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(3)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________
II某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气催化氧化的实验。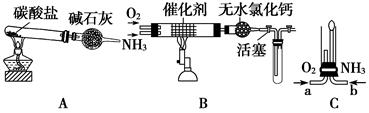
(4)用装置A制取纯净、干燥的氨气,大试管内是碳酸盐;碱石灰的作用是__________________________________。
(5)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是_______________;试管内气体变为红棕色,该反应的化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源:2015届河南省高一下学期第二次月考化学试卷(解析版) 题型:实验题
I甲、乙、丙三位同学分别用如下三套实验装置及化学药品(其中碱石灰为固体氢氧化钠和生石灰的混合物)制取氨气。请你参与探究,并回答下列问题:
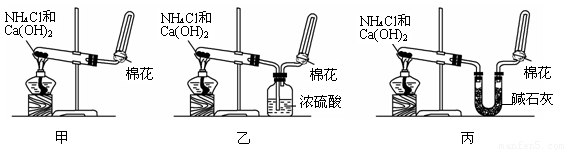
(1)三位同学制取氨气的化学方程式为:_____________________________________________。
(2)三位同学用上述装置制取氨气时,其中乙同学没有收集到氨(如果他们的实验操作都正确),你认为收集不到氨气的主要原因是_____________________________________(用化学方程式表示)。
(3)检验氨气是否收集满的方法是(简述操作方法、现象和结论)_______________________
II某校化学小组学生设计如图装置(图中铁夹等夹持装置已略去)进行氨气催化氧化的实验。
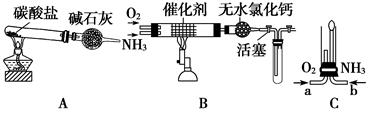
(4)用装置A制取纯净、干燥的氨气,大试管内是碳酸盐;碱石灰的作用是__________________________________。
(5)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨催化氧化的化学方程式是_______________;试管内气体变为红棕色,该反应的化学方程式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com