
根据表中信息判断,下列选项正确的是( )

A.第①组反应的其余产物为H2O
B.第②组反应中Cl2与FeBr2的物质的量之比小于或等于1:2
C.第③组反应中生成1mol Cl2,转移电子5mol
D.氧化性由强到弱顺序为MnO4 >Cl2> Fe3+> Br2
科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高一化学试卷(解析版) 题型:选择题
在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
bB(g)达平衡后,保持温度不变,将容器容积增加一倍,达到新平衡时,B的浓度是原来的60%。则下列叙述正确的是( )
A.a>b B. 平衡向正反应方向移动
C.A的转化率减小 D.B的质量分数减小
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省协作体高三第二次联考理综化学试卷(解析版) 题型:填空题
(15分)硫酸铜在化工和农业方面有很广泛的用处,某化学兴趣小组查阅资料,用两种不同的原料制取硫酸铜。
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:
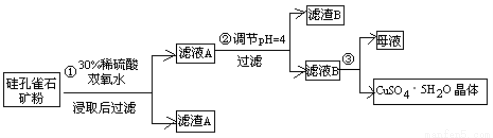
请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
由上表可知:当溶液pH=4时,不能完全除去的离子是________。
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3 饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
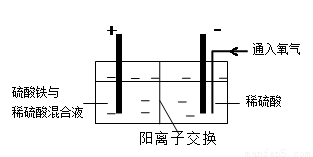
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相) R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)
分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:选择题
乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素 的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示。下列说法不正确的是( )
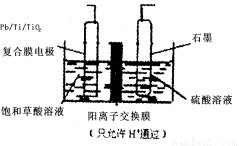
A.电解时石墨电极应与直流电的正极相连
B.阴极反应式为:HOOCCOOH+2H++2e- =OHCCOOH+H2O
C.电解时石墨电极上有O2放出
D.电解一段时间后,硫酸溶液的pH不变化
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省宜春市高三模拟考试理综化学试卷(解析版) 题型:填空题
[化学——选修3:物质结构与性质](15分)
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为____ ,该能层具有的原子轨道数为____ 、电子数为 。
(2)硅主要以硅酸盐、____ 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献____ 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4C1在液氨介质中反应制得SiH4,该反应的化学方程式为___ 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:

①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是 。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是____ 。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为 。Si与O的原子数之比为 。

查看答案和解析>>
科目:高中化学 来源:2013-2014江西省宜春市高三模拟考试理综化学试卷(解析版) 题型:选择题
化学与生活、生产、社会密切相关。下列说法正确的是( )
A.高纯度的单晶硅用于制造登月车的光电池和光导纤维
B.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
C.加碘食盐能使淀粉溶液变蓝
D.有些肾病患者要定期进行血透,血透原理是利用渗析的方法净化血液
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:选择题
如图表示一些物质间的从属关系,不正确的是

| X | Y | Z | H |
A | 分散系 | 胶体 | 溶液 | 盐 |
B | 元素周期表的纵行 | 主族 | 副族 | 卤族 |
C | 电解质 | 酸 | 碱 | 盐 |
D | 化合物 | 共价化合物 | 离子化合物 | 酸 |
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高一文理分科测试化学试卷(解析版) 题型:实验题
(6分)某化学兴趣小组用甲、乙两套装置(如下图所示)进行甲酸(HCOOH)与甲醇(CH318OH)酯化反应的实验,回答以下问题:

(1)甲酸(HCOOH)和甲醇(CH318OH)进行酯化反应的化学方程式是:
___ _。
(2)乙装置中长玻璃导管c的作用是__ ___。
(3)甲、乙两套装置中效果比较好的装置是 ,原因:
(4)试管A和锥形瓶B内装的是 :作用为
。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高二下学期期末考试化学试卷(解析版) 题型:选择题
纳米材料是指颗粒的三维线度中的任一维在1 nm~100 nm范围的材料。纳米技术所带动的技术革命及其对人类的影响,远远超过电子技术。下列关于纳米技术的叙述不正确的是
A.将纳米材料分散到液体分散剂中可制得液溶胶
B.用纳米级金属颗粒粉剂作为催化剂可加快化学反应速率
C.将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,说明“纳米铜”比铜片更易失电子
D.银器能抑菌、杀菌,将纳米银粒子植入内衣织物中,有奇异的抑菌、杀菌效果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com