
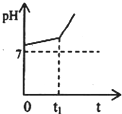
 运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:
运用化学反应原理研究溶液的组成与性质具有重要意义.请回答下列问题:| [NH3?H2O] |
| [NH4+][OH-] |
| 5.56 |
| c(Ca2+) |
| c(Mn2+) |
| [NH3?H2O] |
| [NH4+][OH-] |
| [NH3?H2O] |
| [NH4+][OH-] |
| 1×10-14 |
| 1.8×10-5 |
| 1 |
| 1.8 |
| K×c(NH4+) |
|
| c(Ca2+) |
| c(Mn2+) |


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.15mol/L |
| B、0.3mol/L |
| C、0.225mol/L |
| D、无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaO2具有氧化性,对面粉可能具有增白作用 |
| B、CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O2 |
| C、CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D、CaO2中阴阳离子的个数比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HCO3- |
| B、在pH=1的无色溶液:Fe2+、Mg2+、NO3-、Cl- |
| C、含有大量Al3+的溶液:Na+、C1-、NO3-、OH- |
| D、含大量OH-的溶液中:CO32-、Cl-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向含有少量CaCO3沉淀的水中通入CO2,沉淀溶解;再向溶液中加入Na2CO3溶液,又有CaCO3沉淀生成 |
| B、向Na2CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2CO3的物质的量之比为1:2 |
| C、等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,NaHCO3生成的CO2较多 |
| D、向Na2CO3饱和溶液中通入CO2,有NaHCO3结晶析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| B、烧碱溶液中滴入少量同物质的量浓度的氯化铝溶液 Al3++4OH-═AlO2-+2H2O |
| C、向碳酸钠溶液中滴加少量的稀硫酸:CO32-+2H+═CO2↑+H2O |
| D、氢氧化铁溶于盐酸:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表:
有A、B、C、D、E、F、G七种前四周期元素,原子序数依次增大,其相关信息如表:| 元素 | 元素的相关信息 |
| A | 存在多种核素,其中一种核素没有中子 |
| B | 核外电子排布式三个能级上的电子数相同 |
| C | 其第一电离能比同周期相邻元素的第一电离能都大 |
| D | 最外层电子数是内层电子数三倍的元素 |
| E | 单质或其化合物在火焰灼烧时,火焰呈黄色 |
| F | 位于第三周期ⅦA族 |
| G | 未成对电子数最多的副族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 浓溴水 | 过滤 |
| B | 碘水(水) | 花生油 | 萃取 |
| C | 溴苯(溴) | NaOH溶液 | 分液 |
| D | 鸡蛋清溶液(氯化钠溶液) | 蒸馏水 | 渗析 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com