
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
【答案】(1)![]()
(2)N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=—631.7kJ/mol
(3)AgI(s)+2CN—(aq)![]() Ag(CN)2—(aq)+I—(aq); 1.5×105(4)NH3—5e—+5OH—=NO+4H2O(5)容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大 ;75%
Ag(CN)2—(aq)+I—(aq); 1.5×105(4)NH3—5e—+5OH—=NO+4H2O(5)容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大 ;75%
【解析】
试题分析:(1)用电子式表示氮气的形成过程:![]() ,故答案为:
,故答案为:![]() ;
;
(2)△H等于反应物的键能之和-生成物的键能之和,N2H4 (g)燃烧热的热化学方程式为N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=(390.8×4+193+497.3)-(946+462.8×4)-44×2=—631.7kJ/mol,故答案为:N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=—631.7kJ/mol
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为AgI(s)+2CN—(aq)![]() Ag(CN)2—(aq)+I—(aq);则上述转化方程式的平衡常数K=
Ag(CN)2—(aq)+I—(aq);则上述转化方程式的平衡常数K=![]() =
=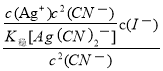 =
=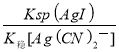 =1.5×105,故答案为:AgI(s)+2CN—(aq)
=1.5×105,故答案为:AgI(s)+2CN—(aq)![]() Ag(CN)2—(aq)+I—(aq);1.5×105
Ag(CN)2—(aq)+I—(aq);1.5×105
(4)氨的催化氧化的方程式为4NH3+5O2═4NO+6H2O,该反应设计成新型电池,在碱性环境下,该电池的负极上氨气失去电子生成一氧化氮气体,电极反应式为NH3—5e—+5OH—=NO+4H2O,故答案为:NH3—5e—+5OH—=NO+4H2O;
(5)①依据反应是放热反应,在绝热恒容容器中,反应进行热量升高,反应速率增大,随反应进行二氧化氮浓度减小,反应为达到平衡,0-3s时v(NO2)增大是由于体系温度升高,故答案为:容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大;
②分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,结合转化率概念计算=![]() ×100%=
×100%=![]() ×100%=75%,故答案为:75%;
×100%=75%,故答案为:75%;


科目:高中化学 来源: 题型:
【题目】【化学——选修3物质结构与性质】铬(Cr)位于第四周期ⅥB族,主要化合价:+2、+3、+6,单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子排布图:____________________,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2晶体类型是________,溶剂CCl4、CS2中的碳原子杂化类型分别是___________、_____________。
(2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1 mol 固体可生成2 mol氯化银沉淀。
则这种浅绿色固体中阳离子的化学式:_____________。
(3)某镧(La)铬(Cr)型复合氧化物具有巨磁电阻效应,晶胞结构如图所示:
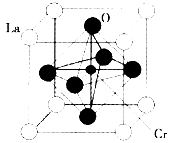
①则其化学式为_________。
②工业上用共沉淀法制备该晶体,以硝酸铬、硝酸镧[La(NO3)3]等金属硝酸盐为原料,以浓氨水为沉淀剂。反应的化学方程式为_________________________________________。
③NH3空间构型为________。
④该晶体中距离氧原子最近的镧原子有________个;若最近的氧原子核间距为a pm,组成物质的摩尔质量为b g·mol-1,阿伏加德罗常数值为NA,则晶体密度的表达式为____________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。某课题组模拟地下水脱氮过程,利用如下装置探究Fe粉和KNO3溶液反应及相关因素对脱氮速率的影响。

实验过程如下:
Ⅰ.原料预处理:①先用0.1mol·L-1H2SO4洗涤Fe粉,然后用蒸馏水洗涤至中性;②将0.01mol/L KNO3溶液的pH调至2.5;③打开弹簧夹,缓慢通入N2,并保持后续反应均在N2氛围中进行;
Ⅱ.加入KNO3酸性溶液100mL,一段时间后铁粉部分溶解,溶液逐渐变为浅绿色;待铁粉不再溶解,静置后发现,剩余固体表面有少量白色物质附着;
Ⅲ.过滤剩余固体时,表面的白色物质变为红褐色;
Ⅳ.检测到滤液中存在NO3-、NH4+、Fe2+。
(1)步骤Ⅰ中用0.1mol L-1H2SO4洗涤Fe粉的目的是 ,通入N2并保持后续反应均在N2氛围中进行的目的是 。
(2)白色物质是 ,用化学方程式解释其变为红褐色的原因: 。
(3)用K3[Fe(CN)6]检验滤液中Fe2+ 的实验方案是 。
(4)取少量滤液,向其中加入几滴KSCN溶液,无明显现象;再加入几滴稀硫酸,溶液呈红色。溶液变成红色的原因是 。
(5)该课题组对影响脱氮速率的因素提出了如下假设,请你完成假设二和假设三:
①假设一:溶液的pH;假设二:____________________;假设二:____________________;
②设计实验验证上述假设一,请完善实验步骤及结论。(已知:溶液中的NO3-浓度可用离子色谱仪测定)
实验步骤:
ⅰ.分别取 的KNO3溶液于不同的试管中;
ⅱ.调节溶液呈酸性且pH各不相同,并通入N2;
ⅲ.分别向上述溶液中加入足量等质量的同种铁粉;
ⅳ.用离子色谱仪测定相同时间内各溶液中NO3-浓度。
实验结论: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修2:化学与技术】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如右图所示:

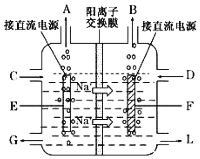
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO![]() 等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
等无机杂质,所以在进入电解槽前需要进行两次精制,得到精制饱和食盐水。
①第一次精制过程中所加除杂试剂顺序不合理的是
A.BaCl2、NaOH、Na2CO3、HCl B.BaCl2、Na2CO3、NaOH、HCl
C.NaOH、BaCl2、Na2CO3、HCl D.Na2CO3、BaCl2、NaOH、HCl
②一次精制后的食盐水仍会有少量的Ca2+、Mg2+,需要送入阳离子交换塔进行二次精制,若不经过二次精制,直接进入离子膜电解槽,这样会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成),则A处产生的气体是 ,F电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1 A的直流电理论上可以产生1.492 g的烧碱,某工厂用300个电解槽串联生产8 h,制得32%的烧碱溶液(密度为1.342 t/m3)113 m3,电解槽的电流强度1.45 ×104 A,该电解槽的电解效率为 (保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为___________________;
(2)已知:①E-E→2E;△H=+a kJmol-1
②2A→A-A;△H=-b kJmol-1
③E+A→A-E;△H=-c kJmol-1(“”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式___________________;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g);△H=-d Jmol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2mol A2、1mol BC | 1mol X | 4mol A2、2mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①该温度下此反应的平衡常数K的值为_____;
②三个容器中的反应分别达平衡时各组数据关系正确的是_____(填序号)
A.α1+α2=1 B.α3<α1 C.n2<n3<1.0mol D.P3<2P1=2P2 E.Q1+Q2=d F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min到新平衡时X的物质的量浓度的变化曲线。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、P、Q为周期表前四周期中原子序数依次增大的元素。X原子2p能级有两个未成对电子,但没有空轨道。Y原子K层的电子数与M层的电子数的乘积等于其L层的电子数。Z与X同族。P原子的基态+2价阳离子的价电子排布为3d2。Q位于第ⅠB族。根据以上信息,回答下列问题。
(1)X的基态原子核外有 种不同运动状态的电子。
(2)Y与X可以形成多种复杂阴离子,如图所示,若其中a对应的阴离子化学式为SiO44—,则c对应的阴离子的化学式为 。
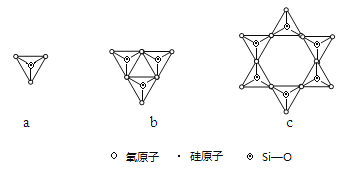
(3)Z能形成很多种含氧酸,如H2ZO3、H2ZO4。Z的某种含氧酸分子式为H2Z2O7,属于二元酸,已知其结构中所有原子都达到稳定结构,且不存在非极性键,试写出其结构式 (配位键须注明)。
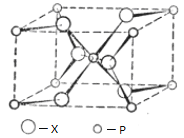
(4)P与X形成的某种晶体的晶胞结构如图所示,其晶体的化学式为 ,P的配位数为 。
(5)向盛有QZX4的溶液中加入氨水至过量,现象为 ,相关反应的离子方程式为 。NF3的空间构型是 ,NF3不易与Cu2+形成配离子,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素①~⑧在元素周期表中的位置如下,回答有关问题:

(1)画出⑥的离子结构示意图__________
(2)在①、②、④、⑤四种元素中,其离子半径按由大到小的排列顺序为 。(示例:用r(A2-)>r(B-)的形式表示)
(3)元素②、③氢化物的稳定性由强到弱的顺序为________(填化学式)。
(4)与③同一主族并且在短周期的元素的某种含氧酸可以消毒杀菌,写出该物质的电子式
(5)表中能形成两性氢氧化物的元素是_______(填元素符号),写出该元素的单质与⑧的最高价氧化物的水化物反应的离子方程式____________________________
(6)已知1mol④的单质在足量②的单质中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列金属防腐的措施中,① 水中的钢闸门连接电源的负极使用的是 法;
② 地下钢管连接镁块使用的是 法。
(2)NO2、O2和熔融NaNO3可制作燃料电池,其原理见右图,石墨Ⅰ为电池的 极;该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,其电极反应式为 。

(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,右图是目前研究较多的一类固体氧化物燃料电池的工作原理示意图。回答下列问题:

① A极为电池 极,电极反应式为 。

② 若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol·L-1的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为 (标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)y在元素周期表中的位置是_______。z、d、e、f四种元素的简单离子中,半径最小的是______(填离子符号)。
(2)g和h氢化物的稳定性由大到小的顺序:_______(用化学式表示)。
(3)元素e和g的同族元素中半径最小元素组成的化合物B中离子半径较大的是______(填离子符号)。
(4)下列可作为比较f和Na随金属性强弱的依据是____。(填序号)
a.测两种元素单质的硬度和熔、沸点
b.比较两元素最高价氧化物对应的水化物溶液的碱(或酸)性强弱
c.比较两种元素在氯化物中化合价的高低
d.比较单质与同浓度盐酸反应的剧烈程度
(5)有人建议将氢元素排在元素周期表的IVA族,请你从化合价的角度给出一个理由_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com