
下列有关溶液组成的描述合理的是( )
A.无色溶液中可能大量存在Al3+、NH 、Cl-、S2-
、Cl-、S2-
B.酸性溶液中可能大量存在Na+、ClO-、SO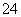 、I-
、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO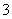
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO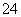
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
碱式碳酸铝镁
[MgaAlb(OH)c(CO3)d·xH2O]常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和________________________________。
(2)MgaAlb(OH)c(CO3)d·xH2O中a、b、c、d的代数关系式为________。
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390 g 样品与足量稀盐酸充分反应,生成CO2 0.560 L(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(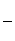 ×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
×100%)随温度的变化如图所示(样品在270 ℃时已完全失去结晶水,600 ℃以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的n(OH-)∶n(CO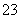 )(写出计算过程)。
)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁为四种主族元素,甲元素与乙、丙、丁三种元素相邻,甲、乙的原子序数之和等于丙的原子序数;这四种元素原子的最外层电子数之和为20。下列判断正确的是
A.原子半径:丙>乙>甲>丁
B.气态氢化物的稳定性:甲>丙
C.最高价氧化物对应的水化物的酸性:丁>甲
D.乙和甲、乙和丁所能形成的化合物都是剧毒物质
| |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、NH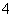 、SO
、SO 、Cl-
、Cl-
B.c(H+)=1×10-13 mol/L的溶液:Na+、Ca2+、SO 、CO
、CO
C.含有大量Fe3+的溶液:Na+、Mg2+、NO 、SCN-
、SCN-
D.含有大量NO 的溶液:H+、Fe2+、SO
的溶液:H+、Fe2+、SO 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D四种化合物,它们分别由K+、Ba2+、SO 、CO
、CO 、OH-、SO
、OH-、SO 离子中的两种组成,它们具有下列性质:
离子中的两种组成,它们具有下列性质:
①A不溶于水和盐酸;②B不溶于水但溶于盐酸并放出无刺激性气味的气体;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出的气体E可使溴水褪色。
(1)写出化学式:A.________、B.________、C.________、D.________、E.________。
(2)写出离子方程式:
B+盐酸___________________________________________________________;
C+硫酸___________________________________________________________;
D+硫酸___________________________________________________________;
E+溴水____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式不正确的是( )
A.测0.1 mol/L氨水的pH为11:
NH3·H2O NH
NH +OH-
+OH-
B.将Na块放入水中,产生气体:
2Na+2H2O===2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:
CuCl2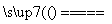 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O===2AlO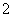 +3H2↑
+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:
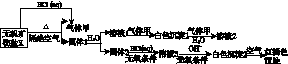
另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为__________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:_____________________________________________________,并设计实验方案验证该反应的产物:__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3===Na++H++CO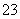
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO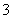 )+c(CO
)+c(CO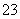 )
)
D. 温度升高,c(HCO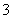 )增大
)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com