
化合物Ⅳ为一种重要化工中间体,其合成方法如下:
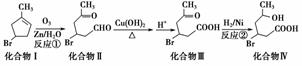
(1)化合物Ⅰ的化学式为________;化合物Ⅳ除了含有—Br还有的官能团是________(填名称)。
(2)化合物Ⅱ具有卤代烃的性质,在一定条件下能生成烯,该反应条件是________。
(3)1 mol化合物Ⅲ与足量NaOH反应消耗NaOH的物质的量为________ mol。
(4)化合物Ⅳ能发生酯化反应生成六元环化合物Ⅴ,写出该反应的化学方程式:__________________________________________。
(5)根据题给化合物转化关系及相关条件,请你推出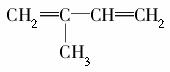 (2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和Ⅶ,结构简式分别是________、________,它们物质的量之比是________。
(2-甲基-1,3-丁二烯)发生类似①的反应,得到有机物Ⅵ和Ⅶ,结构简式分别是________、________,它们物质的量之比是________。
解析 (1)由碳原子的成键特点可知化合Ⅰ的分子式为C6H9Br;化合物Ⅳ中除—Br外还含有的官能团为羟基(—OH)和羧基(—COOH)。(2)卤代烃发生消去反应可得到烯,发生消去反应的条件是NaOH的乙醇溶液、加热。(3)1 mol化合物Ⅲ中含有1 mol —COOH可与1 mol NaOH发生中和反应,含有1 mol—Br,可与1 mol NaOH发生取代反应,可见1 mol化合物Ⅲ最多可与2 mol NaOH反应。(4)发生酯化反应时就是—OH与—COOH 转化为酯基,同时还有H2O生成。(5)反应①是碳碳双键发生断裂,且双键碳上含有氢原子则转化为羰基、没有氢原子则转化为羰基,因此2-甲基-1,3-丁二烯发生类似①的反应可得到HCHO和CH3COCHO,且n(HCHO)∶n(CH3COCHO)=2∶1。
答案 (1)C6H9Br 羟基和羧基 (2)氢氧化钠的乙醇溶液,加热 (3)2
(4)



科目:高中化学 来源: 题型:
在BaSO4饱和溶液中,加入Na2SO4(s),达到平衡时( )
A.[Ba2+]=[SO42-]
B.[Ba2+]=[SO42-]=[Ksp (BaSO4)]1/2
C.[Ba2+]≠[SO42-],[Ba2+]·[SO42-]=Ksp (BaSO4)
D.[Ba2+]≠[SO42-],[Ba2+]·[SO42-]≠Ksp (BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素可以形成多种化合物.回答以下问题:
(1)N≡N的键能为942kJ•mol﹣1,N﹣N单键的键能为247kJ•mol﹣1.计算说明N2中的 键更稳定(填“π”或“σ”).
(2)N2与O22+互为等电子体,O22+的电子式可表示为 .
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被﹣NH2(氨基)取代形成的另一种氮的氢化物.
①NH3分子的空间构型是 ;N2H4分子结构式为 .
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=﹣1038.7kJ•mol﹣1
若该反应中有4mol N﹣H键断裂,则形成的π键有 mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
苹果酸的结构简式为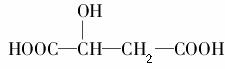 ,下列说法正确的是( )。
,下列说法正确的是( )。
A.苹果酸中能发生酯化反应的官能团有2种
B.1 mol苹果酸可与3 mol NaOH发生中和反应
C.1 mol苹果酸与足量金属Na反应生成1 mol H2
D.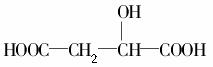 与苹果酸互为同分异构体
与苹果酸互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3 (aq)+S(s)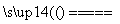 Na2S2O3 (aq)
Na2S2O3 (aq)
实验步骤:
① 称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。 另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
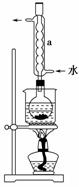
② 安装实验装置(如图所示,部分夹持装置略去),水浴加热, 微沸60分钟。
③ 趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________________________
__________________________________________。
(2)仪器a的名称是________,其作用是__________________________________________
__________________________________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无
机杂质是________。 检验是否存在该杂质的方法是__________________________________________
__________________________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因: __________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂, 用0.100 0 mol·L-1碘的标准溶液滴定。 反应原理为:2S2O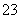 +I2===S4O
+I2===S4O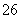 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______________ mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)________。 Ⅲ.Na2S2O3的应用

(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO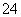 ,常用作脱氯剂,该反应的离子方程式为__________________________________________
,常用作脱氯剂,该反应的离子方程式为__________________________________________
__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
我国目前制备多晶硅主要采用三氯氢硅氢还原法、硅烷热解法和四氯化硅氢还原法。由于三氯氢硅氢还原法具有一定优点,被广泛应用。其简化的工艺流程如下图所示:
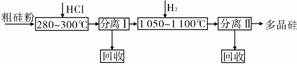
(1)由纯SiHCl3制备高纯硅的化学方程式为________________。该生产工艺中可以循环使用的物质是____________________(写出两种)。
(2)由于SiH4具有易提纯的特点,因此硅烷热分解法是制备高纯硅很有发展潜力的方法,工业上广泛采用的合成硅烷的方法是让硅化镁和固体氯化铵在液氨介质中反应得到硅烷,反应的化学方程式是______________________(不需注明反应条件,下同);整个制备过程必须严格控制无水,否则反应将不能生成硅烷,而是生成硅酸和氢气等,其化学方程式为_____________ _____;整个系统必须与空气隔绝,其原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
亚氯酸盐(如NaClO2)可用作漂白剂,在常温下不见光时可保存一年,但在酸性溶液中因生成亚氯酸而发生分解:5HClO2===4ClO2↑+H++Cl-+2H2O。分解时,刚加入硫酸,反应缓慢,随后突然反应释放出大量的ClO2,这是因为( )
A.酸使亚氯酸的氧化性增强
B.溶液中的H+起催化作用
C.溶液中的Cl-起催化作用
D.逸出的ClO2使反应生成物的浓度降低
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,下列说法正确的是(双选)( )
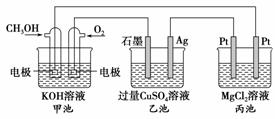
A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO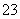 +8H+
+8H+
C.反应一段时间后,向乙池中加入一定量CuO或CuCO3固体能使CuSO4溶液恢复到原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com