
【题目】某小组对反应2X (g) + Y(g)2Z(g)进行对照实验(见下表)。下列有关说法错误的是( )
实验序号 | 反应温度 | c(X)mol/L | c(Y)mol/L |
1 | 400℃ | 2 | 1 |
2 | 400℃ | 2 | 2 |
A.该反应为可逆反应B.探究温度对反应速率的影响
C.探究浓度对反应速率的影响D.实验2的反应速率较快
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】以铬酸钾为原料,用电解法制备重铬酸钾的实验装置如图,下列说法不正确的是

A. 在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B. 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向左移动
C. 该制备过程总反应的化学方程式为:4K2CrO4+4H2O![]() 2K2Cr2O4+4KOH+2H2↑+O2↑
2K2Cr2O4+4KOH+2H2↑+O2↑
D. 测定阳极液中K和Cr的含量。若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为2-d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150 mL 4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24 L NO(标准状况),往所得溶液中加入KSCN溶液,无血红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( )
A. 0.21 mol B. 0.25 mol C. 0.3 mol D. 0.35 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的利用是国际社会普遍关注的问题。
(1)CO2的电子式是______。
(2)CO2在催化剂作用下可以直接转化为乙二醇和甲醇,但若反应温度过高,乙二醇会深度加氢生成乙醇。
![]()
获取乙二醇的反应历程可分为如下2步:
Ⅰ.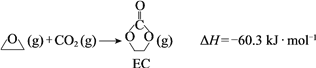
Ⅱ.EC加氢生成乙二醇与甲醇
![]()
① 步骤Ⅱ的热化学方程式是______。
② 研究反应温度对EC加氢的影响(反应时间均为4小时),实验数据见下表:
反应温度/ ℃ | EC转化率/ % | 产率/ % | |
乙二醇 | 甲醇 | ||
160 | 23.8 | 23.2 | 12.9 |
180 | 62.1 | 60.9 | 31.5 |
200 | 99.9 | 94.7 | 62.3 |
220 | 99.9 | 92.4 | 46.1 |
由上表可知,温度越高,EC的转化率越高,原因是______。温度升高到220 ℃时,乙二醇的产率反而降低,原因是______。
(3)用稀硫酸作电解质溶液,电解CO2可制取甲醇,装置如下图所示,电极a接电源的______极(填“正”或“负”),生成甲醇的电极反应式是______。

(4)CO2较稳定、能量低。为实现CO2的化学利用,下列研究方向合理的是______(填序号)。
a.选择高能量的反应物和CO2反应获得低能量的生成物
b.利用电能、光能或热能活化CO2分子
c.选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.6mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到2.24L气体(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是
A. 上述电解过程中共转移0.2mol电子
B. 原混合溶液中c(K+)为0.2mol·L-1
C. 电解得到的Cu的物质的量为0.05mol
D. 电解后溶液中c(H+)为0.2mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为能减少环境污染的是( )
A.含氮、磷化合物的废水大量排放B.农业生产中农药、化肥的大量使用
C.实现煤的清洁利用,大力开发新能源D.使用含有甲醛、氡等的材料装修房子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠晶体,但现在只有混有硫酸钠、碳酸氢铵的氯化钠。已知:NH4HCO3![]() NH3↑+H2O+CO2↑。某学生设计了如下方案:
NH3↑+H2O+CO2↑。某学生设计了如下方案:

![]()
![]()
请回答下列问题:
(1)步骤①加热的目的是_____。
(2)写出步骤②中发生的离子方程式_____。
(3)步骤②,判断SO42-已除尽的方法是_______________________________________。
(4)步骤③的目的是_____,操作1用到的玻璃仪器有_____。
(5)操作2的名称是_____,应在_____(填仪器名称)中进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:
(1)在恒温、恒容密闭容器中发生反应:H2C2O4(s)![]() H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。
A.压强不再变化 B.CO2(g)的体积分数保持不变
C.混合气体密度不再变化 D.混合气体平均摩尔质量保持不变
(2)草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:

①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
②25℃时,反应C2O42-+H2C2O4-![]() 2HC2O4-的平衡常数的对数值1gK=____________。
2HC2O4-的平衡常数的对数值1gK=____________。
(3)向10mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)____________10mL(填“>”“=”或“<”)。
(4)草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取mg草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是____________;该过程中发生反应的离子方程式为____________;滴定过程中消耗VmLKMnO4标准溶液,草酸晶体纯度为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com