
【题目】已知液氨的性质与水相似。T℃时,NH3+NH3![]() NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
NH4++NH2-,NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )
A. 在此温度下液氨的离子积为1×10-17
B. 在液氨中放入金属钠,可生成NaNH2
C. 恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小
D. 降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______族,其基态原子中未成对电子个数为________。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________,所含非金属元素的电负性由大到小的顺序是_____________________________。
(3)尿素[CO(NH2)2]分子中,碳原子为_______杂化,分子中σ键与π键的数目之比为_________。
(4)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为__________。

(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为__________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)、如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
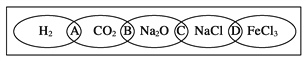
(1)请将分类依据代号填入相应的括号内:
(______)两种物质都不是电解质
(______)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________。
②证明有红褐色胶体生成的实验操作是________________________________________。
(Ⅱ)反应:A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水是氧化剂的是______,水是还原剂的是________。(填序号)
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O,还原剂与氧化剂的物质的量之比:_______,当有0.6mol电子转移时。生成的NO在标准状况的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述中,不正确的是( )
A.Cl2常用于自来水消毒B.SO2常用于漂白食品
C.SiO2常用于制造光导纤维D.含碘食盐可预防甲状腺肿大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1。则相同条件下破坏1mol NO分子中的化学键需要吸收的能量为_______kJ。
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固体,则溶液中![]() _______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_________________。
_______(填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_________________。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。
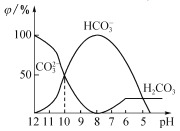
①在同一溶液中,H2CO3、HCO3-、CO32-______(填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________。溶液中各种离子的物质的量浓度大小关系为______________。
③反应的CO32-+H2O![]() HCO3-+OH-的平衡常数Kh=______________________。
HCO3-+OH-的平衡常数Kh=______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮酸钠(NaN3)是汽车安全气囊的产气剂,Fe2O3是主氧化剂,NaHCO3作冷却剂。当汽车发生剧烈碰撞时,分解产生大量气体使安全气囊迅速打开,从而起到安全保护作用[已知Ka(HN3)=1.8×10-5]。下列有关说法正确的是
A. NaHCO3的冷却原理是它发生分解,消耗体系的热量
B. Fe2O3和Na反应的氧化产物是Na2O2
C. 等物质的量的NaN3和HN3混合溶液显碱性
D. 若有6.5 gNaN3分解产生N2,则转移0.9 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙属于桥环化合物,是一种医药中间体,可以通过以下反应制得:
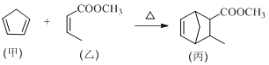
下列有关说法正确的是
A. 甲分子中所有原子可能处于同一平面上
B. 乙可与H2按物质的量之比1∶2发生加成反应
C. 丙能使酸性高锰酸钾溶液、溴的CCl4溶液褪色,且原理相同
D. 等物质的量的甲、乙分别完全燃烧时,消耗氧气的质量之比为13∶12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
![]()
下列有关说法正确的是
A. ①煮沸的主要目的是为了除去溶解的CO2
B. ②的反应中H2O2作氧化剂,氨水用来调节溶液的pH
C. ②中结晶的颗粒较小,过滤时可用玻璃棒轻轻搅动
D. ③醇洗的主要目的是为了减少晶体的损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com