
| 滴定次数 | 待测液体积 (mL) |
标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| 0.2010mol/L×20mL |
| 10mL |
| 4.02g |
| 4.3g |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |
| c(标准)V(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
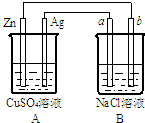 如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.
如图所示的装置中电极a、b均为碳棒,两烧杯中所盛溶液均为500mL 1.0mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度t(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=
高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)?Fe(s)+CO2(g)(正反应是吸热反应),其平衡常数可表示为:K=| c(CO2) |
| c(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、20℃20mL0.1mol/L稀盐酸与块状大理石 |
| B、20℃20mL0.1mol/L稀盐酸与粉末状大理石 |
| C、30℃10mL0.5mol/L稀盐酸与块状大理石 |
| D、30℃10mL0.5mol/L稀盐酸与粉末状大理石 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com