
| A. | Na2CO3 固体中混有少量NaHCO3:加热固体至质量恒定 | |
| B. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| C. | CO2中混有HCl:将其通过装NaOH溶液的洗气瓶 | |
| D. | NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液 |
分析 A.NaHCO3不稳定,解热可分解生成Na2CO3;
B.溶液中Na2CO3能与CO2、H2O反应生成NaHCO3;
C.二者都可与氢氧化钠溶液反应;
D.碘易溶于四氯化碳.
解答 解:A.NaHCO3不稳定,解热可分解生成Na2CO3,可用于除杂,故A正确;
B.向Na2CO3中通入二氧化碳,会反应生成碳酸氢钠溶液,达到除杂的目的,故B正确;
C.二者都可与氢氧化钠溶液反应,应用饱和碳酸氢钠溶液,故C错误;
D.碘易溶于四氯化碳,可用萃取的方法除杂,故D正确.
故选C.
点评 本题考查物质的分离、提纯及除杂,为高频考点,把握物质的性质及混合物分离提纯方法为解答的关键,注重基础知识的考查,注意除杂的原则,题目难度不大.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
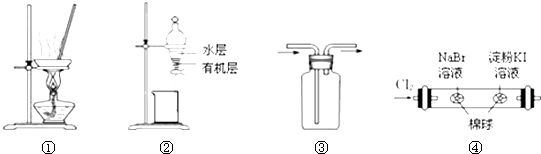
| A. | 用图①所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 用图②所示装置,分离CCl4萃取碘水后的有机层和水层 | |
| C. | 按装置③所示的气流方向可用于收集H2、NH3等 | |
| D. | 用图④所示装置,可以证明氧化性:Cl2>Br2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知室温下,某些弱酸的电离常数如下:
已知室温下,某些弱酸的电离常数如下:| CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | 1.7×10-5 | Ka1=4.2.×10-7 Ka2=5.6.×10-11 | 3×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gCH4含有10NA个电子 | |
| B. | 0.1mol•L-1的盐酸溶液中含有0.1NA个H+ | |
| C. | 1molNa与乙醇完全反应,失去2NA个电子 | |
| D. | 标准状况下,22.4L苯含有NA个苯分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 组成元素 | B、C | A、C | A、D | C、D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属性:N>P>As>Sb>Bi | B. | 酸性:HNO3>H3PO4>H3AsO4>H3SbO4 | ||
| C. | 稳定性:NH3<PH3<AsH3<SbH3 | D. | 稳定性:HCl>H2S>PH3>SiH4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com